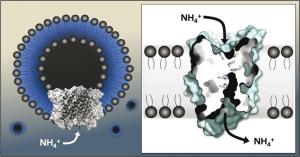
Haben die Proteine das Gas Ammoniak oder das Ion Ammonium im Gepäck? Und ist das ein aktiver oder ein passiver Transport? Lange rätselten Biochemikerinnen und Biochemiker über die Eigenschaften der Ammoniumtransportproteine (Amt), zu denen auch der Rhesus-Faktor, der als Blutgruppensystem bekannt ist, gehört. Bekannt war bisher, dass die Amt-Proteine Stickstoff in Bakterienzellen transportieren - in Pflanzen und Bakterien sind sie für dessen Aufnahme unerlässlich.
Bei Mensch und Tier regulieren sie den Säure- und Ionenhaushalt des Körpers. Ein Team von Wissenschaftlerinnen und Wissenschaftlern um Prof. Dr. Susana Andrade vom Institut für Biochemie der Universität Freiburg und Mitglied des Exzellenzclusters BIOSS Centre for Biological Signalling Studies, hat mit elektrophysiologischen Tests an synthetischen Lipidvesikel die Eigenschaften des Amt-Proteins mit großer Genauigkeit bestimmt.
Die Wissenschaftler verwendeten Proteine, die aus der Zellmembran von so genannten Archaeen stammen, Einzellern, die unter extremen Umweltbedingungen leben. Die Freiburger Forscherinnen und Forscher klärten bereits 2005 die Kristallstruktur eines solchen Proteins auf. Nun fügten sie die Proteine in eine Schicht von Lipidmolekülen ein, an der sie Ionenströme direkt messen können. Das Team entdeckte, dass eine positive Ladung durch die Membran wandert: Nicht das Gas Ammoniak NH3, sondern das Ammonium-Ion NH4+ wird transportiert. Ihre Ergebnisse haben die Forscher in der Fachzeitschrift "Proceedings of the National Academy of Sciences of the USA" veröffentlicht [siehe Artikelhinweis unten].
"Die Erkenntnisse lassen sich zum großen Teil auf die Rhesus-Proteine der Säuger übertragen", sagt Andrade. Die Amt-Proteine ähneln stark den Rhesus-Proteinen des Menschen. Die Forscher testeten drei Amt-Proteine, die in den Bakterien vorkommen und bestimmten außerdem die Geschwindigkeit, mit der sie Ammonium durchlassen. "In Zukunft wollen wir einzelne Komponenten des Transporters verändern, um die genauen chemischen Vorgänge besser zu verstehen", erklärt Andrade.
Der wissenschaftliche Streitpunkt um das Amt-/Rh-Protein entstand aus der Schwierigkeit, Ammoniak und Ammonium in Messungen zu unterscheiden, da die beiden Moleküle in einem ständigen Gleichgewichtsverhältnis mit Protonen ineinander umgewandelt werden. "Mit unserer In-vitro-Methode erreichen wir eine Genauigkeit, die endlich gültige Schlussfolgerungen über den Transportprozess zulässt." betont die Forscherin.
Zusatzinformationen:
Tobias Wacker, Juan J. Garcia-Celma, Philipp Lewe und Susana L. A. Andrade:
Direct observation of electrogenic NH4+ transport in ammonium transport (Amt) proteins.
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 04. Juni 2014, DOI 10.1073/pnas.1406409111
Quelle: Albert-Ludwigs-Universität, Freiburg im Breisgau
Aktualisiert am 30.06.2014.
Permalink: https://www.internetchemie.info/news/2014/jun14/synthetische-ipidvesikel.php
© 1996 - 2024 Internetchemie ChemLin