Wissenschaftlern der Tschechischen Akademie der Wissenschaften Prag und der TU Braunschweig ist es gelungen, den Auslöser für die heftige Reaktion von Alkalimetallen mit Wasser aufzuklären. Die aus dem Chemieunterricht allseits bekannte Reaktion, die mitunter zu einer heftigen Explosion führen kann, wird demnach durch eine drastische Änderung der elektrischen Ladung hervorgerufen und nicht, wie bisher angenommen, allein durch die Entzündung des dabei entstehenden Knallgases.
Alkalimetalle wie Lithium oder Natrium werden unter anderem bei der Batterieherstellung oder beim Betrieb von Atomkraftwerken eingesetzt.
Die Reaktion von Natrium und Wasser zählt zu den klassischen Lehrbuchexperimenten im Chemieunterricht: Gibt man ein Stück Natrium oder ein anderes Alkalimetall in Wasser, entwickelt sich schnell eine starke Reaktion, die auch zu einer heftigen Explosion führen kann. Als Ursache für das explosive Verhalten wurde bislang nur Wasserstoff angenommen. Dieser entsteht bei der chemischen Reaktion und würde sich in Folge starker Wärmeentwicklung als Knallgasgemisch entzünden, erklärt Prof. Sigurd Bauerecker vom Institut für Physikalische und Theoretische Chemie der TU Braunschweig.
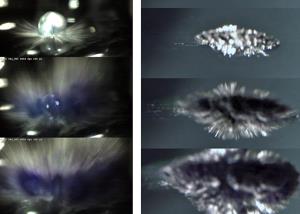
Aktuelle Forschungsergebnisse, die der Prager Physiker Prof. Pavel Jungwirth zusammen mit seinem Braunschweiger Kollegen und langjährigem Kooperationspartner in der unten zitierten Ausgabe der Zeitschrift 'Nature Chemistry' veröffentlicht hat, revidieren nun die bisherige Erklärung für die chemische Reaktion. Umfangreiche Molkühldynamik-Simulationen der Tschechischen Akademie der Wissenschaften führten zu der Annahme, dass eine so genannte Coulomb-Explosion der Auslöser sein könnte. "Das Natrium gibt beim Wasserkontakt Elektronen ab, so dass positive Ladung zurückbleibt. Dadurch stoßen sich diese Metallatome so heftig voneinander ab, dass metallische ‚Finger‘ aus dem Alkalimetalltropfen herausschießen, womit sich schlagartig die Oberfläche vergrößert und was dann zur explosiven Reaktion führt", erläutert Bauerecker.
Experimentell bestätigt wurde die Hypothese der Prager Wissenschaftler mithilfe leistungsstarker Hochgeschwindigkeits-Kameras in Braunschweig. So konnte die Reaktion mit einer Geschwindigkeit von über 11.000 Bildern pro Sekunde bei gleichzeitig hoher optischer Auflösung festgehalten werden.
"Dieses Forschungsergebnis ist ein schönes Beispiel dafür, wie der technische Fortschritt in der optischen Analysetechnik dabei helfen kann, auch alte Fragestellungen der Chemie neu aufzuklären", freut sich Bauerecker und ergänzt: "Vielleicht können unsere Ergebnisse auch dazu beitragen, langfristig einen noch sicheren Umgang mit Alkalimetallen zu ermöglichen. Allerdings gibt es dafür noch einige weitere Fragen zu klären".
Zusatzinformationen:
Philip E. Mason, Frank Uhlig, Václav Vanek, Tillmann Buttersack, Sigurd Bauerecker und Pavel Jungwirth:
Coulomb explosion during the early stages of the reaction of alkali metals with water.
In: Nature Chemistry; online veröffentlicht am 26. Januar 2015, DOI 10.1038/nchem.2161
Quelle: Technische Universität Braunschweig
Aktualisiert am 29.01.2015.
Permalink: https://www.internetchemie.info/news/2015/jan15/coulomb-explosion-alkalimetalle.php
© 1996 - 2024 Internetchemie ChemLin