|
Weitere Infos: |
|
|
|
|
Jenaer Wissenschaftler erforschen molekularen Kontrollpunkt der Zellteilung |
|
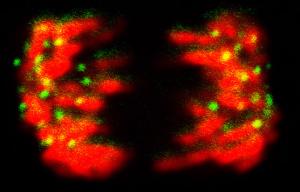
Ohne Zellteilung gibt es weder Wachstum noch Regeneration. Die genetische Information muss dabei gleichartig auf die Tochterzellen aufgeteilt werden. Dabei werden die genetisch identischen Schwesterchromatiden eines Chromosoms voneinander getrennt. Das so genannte Zentromer - die "schmale Taille" eines Chromosoms - ist für die korrekte Trennung des genetischen Materials während der Zellteilung verantwortlich. Dort befindet sich beidseitig das so genannte Kinetochor, ein Proteinkomplex, an dem von beiden Zellpolen aus die Spindelfasern andocken, um die Schwesterchromatiden auseinander ziehen zu können. |
|
Defekte in der Proteinstruktur des Kinetochors - dem Andockpunkt am Zentromer - führen zu Aneuploidie, Krebs und zellulärer Seneszenz. "Durch die Erforschung der molekularen Grundlagen dieses Kontrollpunktes am Chromosom, können langfristig auch wichtige Grundmechanismen zellulärer Alterungsprozesse verstanden werden", so Stephan Diekmann vom Leibniz Institut für Alternsforschung (Fritz-Lipmann-Institut Jena). Mittlerweile sind zwar fast alle Komponenten dieses Proteinkomplexes bekannt, doch bisher blieb unklar, wie die unterschiedlichen Proteinmolekülezusammenwirken. Jenaer Wissenschaftler aus der Arbeitsgruppe Diekmann haben nun einige dieser Kinetochor-Proteine zum Leuchten gebracht, um Licht in die molekularen Interaktionsprozesse am Zentromer zu bringen. In Echtzeit und an lebenden Zellen konnten Hemmerich und Kollegen mit Hilfe eines Spezialmikroskopes beobachten, wie sich diese "leuchtenden" Proteine am Zentromer verhalten und wie schnell sie dort eingebaut bzw. ausgetauscht werden. "Wir haben insgesamt 6 Proteine untersucht und kamen dabei zu einem erstaunlichen Befund", so Peter Hemmerich. "Während die Zentromer-Proteine CENP-A und CENP-I extrem stabil im Zentromer integriert sind, findet bei den vier anderen Proteinen ein ständiger Austausch statt", erläutert der Molekularbiologe. Dabei war die Stärke der Bindung von CENP-B, CENP-C, CENP-H und hMis12 an das Zentromer sehr unterschiedlich und hat sich über den Zellzyklus hinweg drastisch verändert. Bei der Mitose (Zellteilung) sitzen jedoch alle Proteine fest am Zentromer. "Das macht Sinn, denn in dieser Phase muss die Zugkraft der Spindelfasern über das Zentromer auf die Chromosomen übertragen werden", erklärt Hemmerich. Sonst können die Schwesterchromatiden nicht getrennt werden. "Wir konnten mit Hilfe unserer Forschungen zeigen, dass der Kinetochor-Proteinkomplex aus der Kombination zweier grundsätzlich verschiedener Proteintypen besteht", so Hemmerich und Diekmann. Die einen sind fest am Zentromer verankert und die anderen assoziieren dort nur übergangsweise. Die Wissenschaftler konnten experimentell nachweisen, dass das CENP-A zu den fest eingebauten Molekülen gehört, die sich nicht wieder vom Zentromer ablösen können. "Wir vermuten, dass CENP-A der epigenetische Markierung der Zentromer-DNA dient", so Hemmerich. "Das Marker-Protein wirkt wie ein "Fähnchen" am Chromatin, das Signale an seine molekulare Umgebung abgibt", erklärt der Molekularbiologe. Die Botschaft lautet: Achtung, hier befindet sich das Zentromer! Auch CENP-I ist extrem stabil mit dem Zentromer verbunden. Die Wissenschaftler gehen davon aus, dass dieses Protein die epigenetische Funktion von CENP-A unterstützt. "Diese molekularen Markierungsmechanismen erleichtern die Identifikation des Zellteilungskontrollpunktes", erläutern die Jenaer Wissenschaftler. Nur dann ist eine korrekte Trennung und Aufteilung der genetischen Information bei der Mitose gewährleistet. |
|
|
|
|
Suche nach themenverwandten Internetseiten: |
|
|