Arylboronate sind wichtige Grundstoffe für die industrielle Herstellung zahlreicher Produkte. Dazu gehören Medikamente, Chemikalien für die Landwirtschaft oder Flüssigkristalle für Displays. Für die Synthese der Arylboronate kommen bislang metallhaltige Katalysatoren zum Einsatz, die zum Beispiel Palladium, Iridium oder Nickel enthalten.
Das hat Nachteile: Diese Metalle sind entweder teuer oder toxisch oder beides gleichzeitig. Nickel zum Beispiel kann Allergien auslösen. Wenn es für die Produktion von Medikamenten eingesetzt wird, muss es nach dem Reaktionsprozess mit großem Aufwand wieder aus dem Produkt entfernt werden.
Fortschritt mit Zink-Katalysatoren
Die Würzburger Chemiker Shubhankar Kumar Bose und Todd Marder stellen jetzt einen völlig neuartigen katalytischen Prozess vor, mit dem sich Arylboronate kostengünstiger und umweltverträglicher herstellen lassen. Das ist ihnen mit zinkhaltigen Katalysatoren gelungen. "Zink ist billig, nicht toxisch und auf der Erde reichlich vorhanden", zählt Marder einige Vorteile dieses Metalls auf.
Wie das Team in der Zeitschrift Angewandte Chemie berichtet [siehe Artikel-Hinweis unten], ist bei dieser Forschungsarbeit ein verblüffender Effekt aufgetreten. Die Wissenschaftler können ihn noch nicht hundertprozentig erklären, doch er dürfte in der Fachwelt für Aufsehen sorgen - weil er möglicherweise einen Schlüssel liefert, um viele wichtige Arylboronate künftig noch einfacher synthetisieren zu können.
Simultanes Anknüpfen von Boronatgruppen
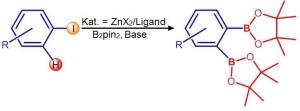
Was die Chemiker in Erstaunen versetzt hat? Für die Herstellung der Arylboronate werden ringförmige Moleküle verwendet, an denen entweder ein Wasserstoff-Atom oder ein Halogen-Atom (Brom, Fluor oder Iod) durch eine so genannte Boronatgruppe ausgetauscht wird. Als die Würzburger diesen Tausch mit ihrem Zink-Katalysator ablaufen ließen, geschah beides gleichzeitig: An dem Ring wurden sowohl das Halogen- als auch ein benachbartes Wasserstoff-Atom durch Boronat ersetzt. Das Ergebnis ist ein Aryl mit zwei Boronatgruppen. Diese Moleküle lassen sich normalerweise nicht so einfach erzeugen und sind für industrielle Synthesen hoch interessant.
"Das war völlig unerwartet", sagt Marder, "und wir wissen bislang nicht, über welchen chemischen Mechanismus das passiert ist." Mit Experimenten haben die Würzburger schon einige Reaktionswege identifiziert, die dafür keinesfalls in Frage kommen. Nach dem Ausschlussverfahren schlagen sie darum in Angewandte Chemie einen möglichen Reaktionsmechanismus vor.
Die nächsten Forschungsschritte
Was bei der Reaktion mit dem Zink-Katalysator genau passiert, wollen die Wissenschaftler als nächstes herausfinden. Außerdem tüfteln sie jetzt daran, die Ausbeute des hoch erwünschten Stoffs zu steigern: Bei der Reaktion entstehen rund 70 Prozent Moleküle mit einer Boronatgruppe und nur circa 30 Prozent Moleküle mit zwei Boronatgruppen.
Evolution in der Katalyse
Dieser Erfolg ist der vorläufige Höhepunkt einer Evolution in der Katalyse, an der Marders Arbeitskreis in den vergangenen Jahren in vorderster Reihe mitgewirkt hat. Die katalysierte Herstellung von Arylboronaten gelang erstmals 1995 mit Palladium in Japan; die entsprechende Reaktion wird nach ihrem "Vater" als Miyaura-Borylierung bezeichnet.
Arylboronate werden für die Suzuki-Miyaura-Reaktion benötigt, für deren Realisierung Akira Suzuki 2010 den Nobelpreis für Chemie bekam. 2009 gelang es in Marders Arbeitskreis, seinerzeit an der Universität Durham in England, solche Reaktionen mit Kupfer-Katalysatoren ablaufen zu lassen. Kupfer ist ein günstiges Übergangsmetall mit geringer Toxizität.
Shubhankar Kumar Bose, der 2013 als Humboldt-Stipendiat zu Marder nach Würzburg kam, hatte schließlich die Idee, es mit Zink als Katalysator zu versuchen. Die Reaktion klappte 2014 zuerst mit kettenförmigen Molekülen (Alkylboronate) und nun auch mit ringförmigen Boronaten. Das bringt einen weiteren Vorteil: Zink ist noch preisgünstiger als Kupfer und nicht toxisch.
Zusatzinformationen:
Shubhankar Kumar Bose, Andrea Deißenberger, Antonius Eichhorn, Patrick G. Steel, Zhenyang Lin und Todd B. Marder:
Simultane Zink-katalysierte C-X- und C-H-Borylierung von Arylhalogeniden.
In: Angewandte Chemie; online erschienen am 18. August 2015, DOI 10.1002/ange.201505603
Quelle: Julius-Maximilians-Universität, Würzburg
Aktualisiert am 20.08.2015.
Permalink: https://www.internetchemie.info/news/2015/aug15/arylboronat-synthese.php
© 1996 - 2024 Internetchemie ChemLin