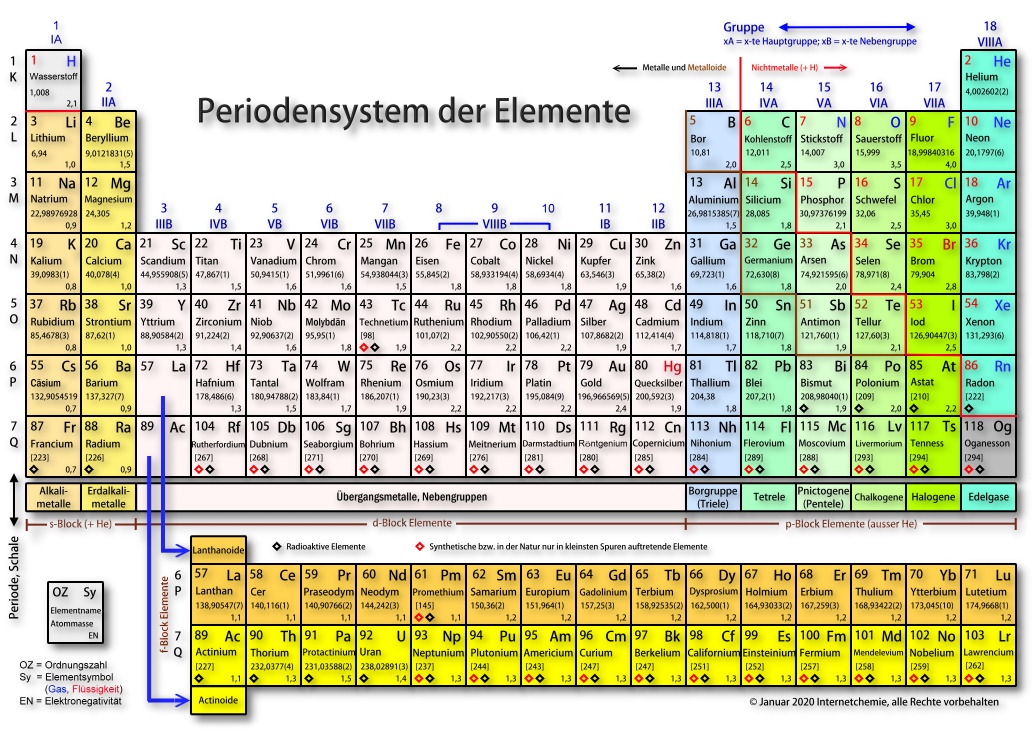
Allgemeines zum Periodensystem der Elemente
Das Periodensystem der chemischen Elemente - kurz PSE genannt - ist eine spezielle tabellarische Übersicht, die die chemischen Grundstoffe aufführt und diese an Hand spezifischer Eigenschaften der einzelnen Atomsorten anordnet. Dabei entspricht die Anordnung der Elemente keinesfalls einem willkürlich erdachten System, sondern sie spiegelt die atomaren Begebenheiten wieder, so dass sich aus der Beschäftigung mit dem Periodensystem ein tiefes Grundverständnis zahlreicher chemischer Gesetzmäßigkeiten und Eigenschaften direkt aus der Tabelle ablesen lassen.
Diese Ordnung bildet vor allem die Grundlage für das Verständnis chemischer Eigenschaften, da sie die Struktur der Elektronenhülle widerspiegelt. Die horizontale Gliederung erfolgt in Perioden, die vertikale in Gruppen. Elemente einer Gruppe besitzen ähnliche chemische Eigenschaften, weil ihre äußerste Elektronenschale gleichartig besetzt ist.
Zentral für den Aufbau des Periodensystems ist das Aufbauprinzip (auch „Prinzip des energetischen Aufbaus“ genannt). Es beschreibt die Reihenfolge, in der Elektronen die verfügbaren Energieniveaus eines Atoms besetzen. Dabei werden die Orbitale - s, p, d und f - gemäß zunehmender Energie aufgefüllt. Zunächst werden die energetisch niedrigeren Orbitale besetzt, bevor Elektronen in höhere Energieniveaus übergehen. Diese Reihenfolge entspricht nicht strikt der numerischen Schalenfolge, sondern folgt der sogenannten Madelung-Regel (n + l-Regel), die den Energieinhalt eines Orbitals bestimmt.
Durch dieses Prinzip entstehen Periodizitäten, also regelmäßig wiederkehrende Eigenschaften der Elemente. Wenn eine Außenschale vollständig besetzt ist und eine neue Periode beginnt, wiederholen sich charakteristische Merkmale wie Reaktivität, Ionisierungsenergie oder Elektronegativität in typischer Weise. So ähneln sich etwa alle Elemente der ersten Hauptgruppe in ihrer Neigung, ein Elektron abzugeben, während die Edelgase am Periodenende besonders stabil und reaktionsträge sind.
Die Struktur des Periodensystems ist damit kein Zufallsprodukt, sondern eine direkte Folge der quantenmechanischen Gesetze, die den Aufbau der Elektronenhülle bestimmen. Das macht es zu einem der mächtigsten Werkzeuge der Chemie: Es ordnet nicht nur bekannte Elemente, sondern erlaubt auch Vorhersagen über Eigenschaften bislang unbekannter.
Element und Ordnungszahl
Ein chemisches Element lässt sich unter anderem über die Atombausteine Protonen und Elektronen definieren: Zwei verschiedene Atome sind demgemäß dann dem gleichen Element zuzuordnen, wenn sie die gleiche Anzahl an positiv geladenen Protonen und - im ungeladenen Zustand - ebenso viele Elektronen aufweisen. Die Anzahl der Protonen ist die so genannte Kernladungszahl bzw. Ordnungszahl; sie entscheidet darüber, zu welchem Element ein Atom zählt. So besteht zum Beispiel Wasserstoff aus einem Proton und einem Elektron; die Ordnungszahl OZ des Wasserstoffs ist 1. Alle Atome mit einem einzigen Proton im Atomkern sind somit Wasserstoff-Atome.
Ein weiterer atomarer Baustein, das ungeladene (neutrale) Neutron bzw. die Anzahl dieses Nukleons im Atomkern, spielt bei dieser Betrachtung keine Rolle. So wird auch ein Atom aus einem Proton und einem oder auch zwei Neutronen dem Wasserstoff zugeordnet. Man spricht bei diesen Atomarten von Isotopen (auf ein bestimmtes Element bezogen) oder allgemeiner von verschiedenen Nukliden.
So werden im Ergebnis die chemischen Elemente an Hand der Protonenzahl fortlaufend nummeriert und im Periodensystem entsprechend dieser Nummerierung fortlaufend von links nach rechts angeordnet.
Kategorie: Chemische Elemente
Aktualisiert am 21. Oktober 2025.
Permalink: https://www.internetchemie.info/chemische-elemente/periodensystem.php
© 1996 - 2026 Internetchemie ChemLin