|
Weitere Infos: |
|
|
|
|
Pannenhelfer für die Antibiotika-Produktion entschlüsselt |
|
Marburger Biochemiker haben gemeinsam mit Kollegen die dreidimensionale Gestalt eines Enzyms aufgeklärt, das Bakterien zur Herstellung von Antibiotika und Fungiziden benötigen. Die Thioesterase-II besitzt ein leicht zugängliches aktives Zentrum, wodurch sie mit einer Vielfalt anderer Strukturen interagieren kann. Das berichteten die Forscher in einer Ausgabe des Wissenschaftsmagazins "Nature" [siehe unten]. |
|
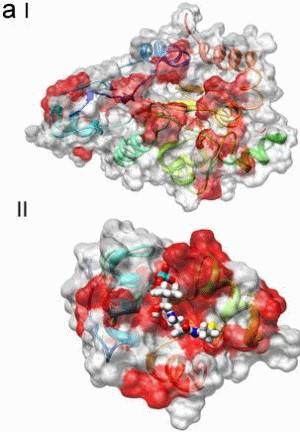
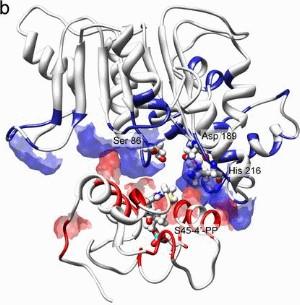
Bakterien nutzen spezielle Enzymkomplexe, um Peptide zu synthetisieren, das sind kurze Aminosäureketten mit mannigfaltiger biologischer Aktivität. Zu den Enzymkomplexen gehören zwei Typen von Thioesterasen, die sich strukturell ähneln, aber unterschiedliche Funktionen erfüllen. Die Thioesterase-II ist dafür verantwortlich, einen an der Synthese beteiligten Kofaktor wiederherzustellen, wenn er eine falsche Seitengruppe trägt, was vermutlich bei vier von fünf Molekülen der Fall ist. Die Bedeutung der Thioesterase-II wird deutlich, wenn man das zugrunde liegende Gen ausschaltet: Die Ausbeute der Peptidsynthese vermindert sich dadurch um 84 Prozent. Die Wissenschaftler um Professor Dr. Mohamed A. Marahiel von der Philipps-Universität und seinen Frankfurter Kollegen Professor Dr. Volker Dötsch beschreiben nun die dreidimensionale Struktur des Reparaturenzyms. Auffällig sind die markanten Unterschiede zu der ansonsten sehr ähnlichen Thioesterase vom Typ I, die sich auf die andersartigen Funktionen zurückführen lassen. Die Biochemiker zeigen, dass die von ihnen untersuchte Thioesterase-II in zwei verschiedenen Konformationen vorliegt. Nur eine davon interagiert mit derjenigen Untereinheit des Enzymkomplexes, an die der fehlerhafte Kofaktor gebunden ist, der T-Domäne. Die Autoren vermuten, dass es sich bei den beiden Konformationen um einen offenen und einen geschlossenen Zustand der Thioesterase-II handelt. Dabei ist das aktive Zentrum des Enzyms in eine flache Grube eingebettet. Dem vorgeschlagenen Modell zufolge befindet sich der Kofaktor eingekeilt zwischen Thioesterase-II und T-Domäne, wie bei einem Sandwich. "Die Form folgt der Funktion", erläutert Mitverfasser Marahiel: Das vergleichsweise frei zugängliche aktive Zentrum "ermöglicht eine eher unspezifische, aber unverzichtbare Reparaturfunktion." Die ebenfalls beteiligte Universität Frankfurt schreibt zu den Ergebnissen:
Mikroorganismen sollen maßgeschneiderte Wirkstoffe produzieren:FRANKFURT. Die meisten Antibiotika werden von Mikroorganismen produziert, die sich in der Natur mithilfe dieses Gifts gegen Konkurrenten durchsetzen. Auf der Suche nach neuen Antibiotika versuchen Forscher die Synthesewege in Mikroorganismen zu nutzen und dabei so zu verändern, dass maßgeschneiderte Wirkstoffe entstehen. "Die zunehmende Resistenz vieler für den Menschen gefährlicher Bakterien gegen fast alle zugelassenen Antibiotika macht diese Suche dringender denn je", erklärt Prof. Volker Dötsch vom Exzellenzcluster Makromolekulare Komplexe der Goethe-Universität. Theoretisch genügt es, in dem modular aufgebauten Syntheseweg ein Modul gegen ein anderes auszutauschen, um einen neuen Wirkstoff zu erhalten. In der Praxis war dieser Ansatz aber bisher wenig erfolgreich, weil das Zusammenspiel der einzelnen Module kaum erforscht ist. Dötsch's Gruppe, die am Institut für Biophysikalische Chemie seit Jahren Bausteine dieses Puzzles zusammenträgt, ist es jetzt gelungen, einen Pannenservice zu entschlüsseln, der eingreift, wenn die Antibiotika-Produktion ins Stocken gerät. Vor zwei Jahren hatte das Team bereits einen "Shuttle-Dienst" entdeckt, mit dessen Hilfe das Antibiotikummolekül während der Synthese von einem Modul zum anderen weitergereicht wird. Kleine, zwischen die Synthesemodule geschaltete Transporteiweiße (Peptidyl-Carrier-Proteine, PCP) befördern das entstehende Molekül von einem Modul zum anderen. Doch wie bei allen linearen Syntheseprozessen besteht auch hier die Gefahr, dass der Ausfall nur eines Moduls die gesamte Produktionskette lahm legt. Besonders anfällig für Störungen sind dabei die Transporteiweiße. Um die kontinuierliche Produktion der für die Mikroorganismen wichtigen Substanzen zu garantieren, hat die Natur daher einen Reparaturservice eingerichtet, der wie ein Pannenservice auf der Autobahn nach defekten Modulen Ausschau hält und wieder instand setzt. Über die molekularen Details dieses wichtigen Reparaturservices, ohne den die Produktion von Antibiotika in den Mikroorganismen um etwa 80 Prozent reduziert wäre, berichtet ein internationales Forscherteam unter der Leitung von Dötsch in der am 14. August erscheinenden Ausgabe der Fachzeitschrift "Nature". Mit Hilfe der Magnetischen Kernspinresonanz (NMR) konnten die Forscher die Struktur und Funktionsweise des Reparatureiweißes Thioesterase II sowie eines Komplexes dieses Proteins mit einem Transporteiweiß aufklären. "Pannen" entstehen, wenn die "Andockstelle" des Transporteiweißes, ein bestimmter Kofaktor, von Molekülen blockiert wird, die nichts mit der Antibiotikasynthese zu tun haben. Doch wie unterscheidet der Pannenhelfer Thioesterase II zwischen einem falsch angedockten Molekül und der wachsenden Antibiotikumkette? Diese Frage konnten die Forscher beantworten, nachdem sie die Struktur der Thioesterase II aufgeklärt hatten. Der Pannenhelfer ist ein großes Eiweißmolekül, dessen aktives Zentrum, in dem die "Reparaturen" stattfinden, sich in einer flachen Mulde befindet. Diese ist gerade groß genug, um den Ko-Faktor, modifiziert mit einem kleinen Molekül aufzunehmen. Größere Moleküle, wie die gerade entstehende Antibiotikumkette, passen in diese mobile Reparaturwerkstatt nicht hinein und werden daher auch nicht angetastet. Pressemitteilung der Volkswagen-Stiftung:
Pannenhilfe der Antibiotikumproduktion entschlüsseltLichtenberg-Professor Peter Güntert legt gemeinsam mit Forscherkollegen neue Erkenntnisse zur Wirkweise von Antibiotika vor. Seit der Entdeckung des Penizillins in den 1920er Jahren versuchen Wissenschaftler unaufhörlich, weitere Antibiotika aus Mikroorganismen zu isolieren - zumeist aus Pilzen oder Bakterien. Da viele krankheitserregende Bakterienstämme zunehmend Resistenzen ausbilden gegen die bekannten und zugelassenen Antibiotika, kommt der Suche nach neuen, geeigneten Substanzen mit antibakterieller Wirkung heute hohe Bedeutung zu. Allerdings ist das Auffinden bisher unbekannter Mikroorganismen, die solche Substanzen synthetisieren, nur ein möglicher Weg, um neuer Antibiotika habhaft zu werden. Ein anderer Weg ist, benötigte Antibiotika direkt herzustellen. Dazu muss man allerdings wissen, wie diese molekular aufgebaut sind und wie sie funktionieren - mithin auch, wie sich ihr molekularer Aufbau verändern lässt. Viele dieser Substanzen bestehen aus einer Kette einzelner Bausteine. Durch Austausch einzelner Module nun kann ein Baustein in dem Antibiotikum gezielt verändert und somit ein neues, maßgeschneidertes Molekül mit neuen Eigenschaften erzeugt werden. Man erhält also ein Antibiotikum, das im Erfolgsfall anders wirkt. Soweit die Theorie. In der Praxis hat dieser Ansatz bisher nur sehr begrenzten Erfolg gehabt. Dies liegt daran, dass man nicht genau weiß, wie das Zusammenspiel der einzelnen Module während der Synthese funktioniert. Vor zwei Jahren entdeckte ein Forscherteam an der Universität Frankfurt am Main einen Mechanismus, mit dessen Hilfe das Antibiotikum-Molekül während der Synthese sozusagen von einem Modul zum anderen weitergereicht wird. Dabei übernehmen kleine "Transport-Eiweiße" - genauer: zwischen die Synthesemodule geschaltete Peptidyl-Carrier-Proteine (PCP) - quasi die Aufgabe eines Förderbandes: Sie gewährleisten so das Weiterreichen. Um nun wiederum die kontinuierliche Produktion dieser für die Mikroorganismen so wichtigen Substanzen zu garantieren, hat die Natur sicherheitshalber einen "Pannenservice" für die Peptidyl-Carrier-Proteine, eingerichtet. Er hält nach defekten Modulen Ausschau und setzt diese wieder instand. Soweit die Vorgeschichte. Die molekularen Details dieses wichtigen Reparaturservices, ohne den die Produktion von Antibiotika in den Mikroorganismen wohl um rund 80 Prozent reduziert würde, hat jetzt ein internationales Forscherteam um Professor Dr. Volker Dötsch und den von der VolkswagenStiftung mit 1,25 Millionen Euro geförderten Lichtenberg-Professor Dr. Peter Güntert von der Goethe Universität Frankfurt am Main und dem Frankfurt Institute of Advanced Studies (FIAS) aufgeklärt. Die Ergebnisse werden am 14. August 2008 in der Zeitschrift Nature veröffentlicht. Den Wissenschaftlern ist es gelungen, zum ersten Mal Einzelheiten der Funktionsweise des Pannenservices zu klären. Mit Hilfe der NMR-Spektroskopie (Nuclear Magnetic Resonance-Spektroskopie) ermittelten sie die Struktur des Reparatur-Eiweißes Thioesterase II sowie eines Komplexes dieses Proteins mit einem Peptidyl-Carrier-Protein. Der wichtigste Teil des PCP-Transporteiweißes ist dabei ein spezieller Ko-Faktor (4'-Phosphopantethein), an den die Syntheseprodukte der einzelnen Module gebunden werden. Durch ihn kann die Weitergabe zum nächsten Modul erfolgen. "Durch die Aufklärung der Funktionsweise und der strukturellen Unterschiede zweier essenzieller Komponenten der Antibiotika-Synthesekette sind wir nun der gezielten Synthese neuer, maßgeschneiderter Substanzen wieder ein Stück näher gekommen", bringt es Professor Peter Güntert auf den Punkt. |
|
|
|
|
Suche nach themenverwandten Internetseiten: |
|
|