Ob Verträglichkeit von Kontaktlinsen oder Anwachsen von Muscheln an Schiffsrümpfen: In beiden Fällen spielen Proteine eine maßgebliche Rolle. Sie bilden beim ersten Kontakt mit dem Körper einen Biofilm aus - ein komplexer Prozess, der sich nur schwer untersuchen lässt. Mit einer neuen Methode, die Bochumer Forscher gemeinsam mit Kollegen in Frankfurt und Marburg entwickelt haben, werden sich die Regeln leichter entschlüsseln lassen: Die Forscher lassen einen maßgeschneiderten molekularen Pelz auf Oberflächen wachsen, dessen "Haare" aus Peptiden, kurzen Proteinen, bestehen.
Durch die Wahl des Peptids lässt sich steuern, welche Proteine sich an den molekularen Pelz anlagern und welche nicht. Mit einem speziellen Peptid schufen sie sogar eine komplett proteinabweisend Oberfläche - wünschenswert z.B. für Kontaktlinsen. Über ihre neue Methode berichteten sie im Journal of the American Chemical Society.
Proteinreste bestimmen über Abstoßungsreaktion von Implantaten
Beim ersten Kontakt von körperfremdem Material, wie zum Beispiel Implantaten, mit den Körperflüssigkeiten heften sich sofort Proteine an die Oberfläche an. Dabei nehmen sie allerdings Schaden, verlieren ihre Funktion und bilden einen Biofilm aus. Die genaue Beschaffenheit dieses Biofilms - die von der Oberfläche des Materials und der Vorbehandlung abhängt - bestimmt dann, ob das Implantat vom Körper abgestoßen wird oder wie gewünscht einwächst. Ein genaues Verständnis dieser Vorgänge wird dadurch erschwert, dass die adsorbierten Proteinschichten sehr komplex sind und sich dementsprechend einer sorgfältigen Untersuchung entziehen.
Peptidpelz wächst auf Goldtablett
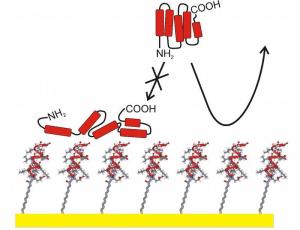
Um solche Schichten näher zu untersuchen haben Forscher der Ruhr-Universität vom Lehrstuhl für Physikalische Chemie I (Prof. Dr. Christof Wöll) und dem Lehrstuhl für Anorganische Chemie I (Prof. Dr. Nils Metzler-Nolte) eine neue Klasse von Molekülen entwickelt, mit der sich Biofilme mit maßgeschneiderten Eigenschaften herstellen lassen. Dazu versehen sie zuerst kurze Eiweißketten (Peptide) aus wenigen Aminosäuren mit einem molekularen Anker. Kommen diese Molekülhybride in Kontakt mit Gold, verankern sie sich auf der Oberfläche und bilden einen Pelz aus, dessen Dicke der Länge der Moleküle entspricht. Die Goldoberfläche ist extrem flach und dient dann als "Tablett", auf dem die Peptidpelze mit verschiedenen Methoden genau untersucht werden können. Besonders gut eignet sich dieses Tablett dafür, das Anheften von Proteinen zu untersuchen. Mit einer gängigen Methode, der Oberflächenplasmonenspektroskopie (Engl.: SPR, für surface plasmon resonance) lässt sich sehr schnell feststellen, welche Proteine wie stark am Petpidpelz haften. Damit lassen sich dann Vorhersagen zu einer eventuellen Abstoßung durch das menschliche Immunsystem treffen.
Kein Protein lagerte sich an
Um die große Flexibilitat der Herstellungsmethode dieser Haftanker-Peptide zu demonstrieren, verwendeten die Bochumer eine Peptidsequenz, die sich möglichst proteinabstoßend verhalten sollte. Ein Test der so erzeugten Biobeschichtung erbrachte dann ein überraschendes Resultat: Schon für die erste untersuchte Sequenz war die Proteinabstoßung schon fast so stark wie die der bisher besten Substanz, die für diesen Zweck eingesetzt wird. Etwas verwundert über diesen Überraschungserfolg erzählt Prof. Wöll: "Wir haben bei der Wahl der ersten Peptidsequenz lediglich berücksichtig, dass hydrophile, also benetzende Beschichtungen eher proteinabstoßend wirken, genauso wie Peptide mit einer Windung." Das Resultat war eine Oberfläche, an die sich kein Protein anlagern konnte. Solche Eigenschaften wünscht man sich zum Beispiel für Schiffsrümpfe, an denen sonst gern Muscheln haften, die den Widerstand erhöhen und somit auch den Treibstoffverbrauch. Auch für Kontaktlinsen wäre diese Eigenschaft wünschenswert - die tägliche Reinigung könnte dann vielleicht entfallen. Bei der Entwicklung von Implantatmaterialien geht es aber eher darum, Oberflächen zu erzeugen, an die sich nur bestimmte Proteine anlagern, damit ein festes Einwachsen in den Körper erfolgt. "Unsere Methode wird dabei mithelfen, solche Materialien maßzuschneidern", meint Prof. Wöll.
SAMs bauen sich selbst
Eine der Grundlagen für die Entwicklung dieser biokompatiblen Beschichtungen sind durch Selbstassemblierung aufwachsende Monoschichten aus Organothiolen, die auch als SAMs bezeichnet werden (englisch: Self Assembled Monolayers). Diese ultradünnen, aber strukturell sehr gut definierten molekularen Schichten werden am Lehrstuhl für Physikalische Chemie I bereits seit über zehn Jahren intensiv untersucht und im Hinblick auf eine ganze Reihe von Einsatzmöglichkeiten weiterentwickelt. Wichtig in diesem sehr interdisziplinären Forschungsgebiet ist die intensive Zusammenarbeit der Physikalischen Chemie mit synthetisch arbeitenden Chemikern, die die entsprechenden Organothiole herstellen können. Für die Haftanker-Peptide, die für dieses Projekt eingesetzt werden, wurde eine erst kürzlich entdeckte und von Prof. Metzler-Nolte weiterentwickelte Methode, die sogenannte "Klick"-Chemie eingesetzt. Damit lassen sich ganz unterschiedliche Moleküle - in diesem Fall das Peptid und der Haftanker - einfach "zusammenklicken".
Zusatzinformationen:
Rolf Chelmowski, Stephan David Koster, Andreas Kerstan, Andreas Prekelt, Christian Grunwald, Tobias Winkler, Nils Metzler-Nolte, Andreas Terfort, and Christof Wöl:
Peptide-Based SAMs that Resist the Adsorption of Proteins.
In: Journal of the American Chemical Society; J. Am. Chem. Soc., 130 (45), 14952-14953, 2008, DOI 10.1021/ja8065754
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 14.11.2008.
Permalink: https://www.internetchemie.info/news/2008/nov08/biomimetische-oberflaechen-aus-molekularen-pelzen.php
© 1996 - 2026 Internetchemie ChemLin