Der genetische Bauplan enthält Informationen für lediglich 20 Aminosäuren (AS). Ließe sich dieses Repertoire erweitern, könnten z.B. Bakterien so programmiert werden, dass sie maßgeschneiderte Proteine mit den verschiedensten für Wissenschaft, Technik oder Medizin interessanten Funktionen herstellen. In der Tat lässt sich die natürliche Protein-Herstellungsmaschinerie umprogrammieren, bisher konnte allerdings immer nur je eine Sorte einer neuen AS in ein Protein eingebaut werden.
Wenshe Liu und seinen Kollegen von der Texas A&M University (USA) ist es jetzt gelungen, zwei verschiedene nichtnatürliche AS im Erbgut von Bakterien zu verankern, wie sie in der Zeitschrift Angewandte Chemie berichten [siehe unten].
Um ein Protein zu synthetisieren, zieht eine Zelle zunächst eine "Blaupause" (mRNA) des entsprechenden Gens und "liest" diese ab (Translation). Der genetische Code für jede AS besteht aus jeweils drei "Buchstaben" (Nukleotiden). Außerdem gibt es ein Startcodon und drei verschiedene Codons, die "Stopp" bedeuten. "Transporter" (tRNA), die die Codons spezifisch erkennen, werden mit der entsprechenden AS beladen und bringen sie zum Ort der Proteinsynthese (Ribosomen). Als "Belader" fungieren spezielle Enzyme (Aminoacyl-tRNA-Synthetasen).
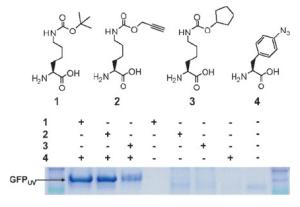
Nur 20 AS sind codiert, man nennt sie die kanonischen AS. Andere AS sind für den Organismus zugänglich, indem er einzelne AS später im fertigen Protein modifiziert. Einige Bakterien jedoch, die eine ungewöhnliche AS als Teil von Enzymen ihres Methan-Stoffwechsels benötigen, zweckentfremden dafür eines ihrer Stopp-Codons (amber), das hier als Codon für die zusätzliche AS fungiert. Im Labor wurde diese Methode bereits erfolgreich nachgeahmt. Liu und sein Team nutzten nun erstmals zwei solcher bakteriellen Systeme parallel. Eine der tRNAs mutierten sie dafür so, dass diese nun ein anderes Stopp-Codon (ochre) erkennt. Durch Mutation konnten sie die zugehörigen Aminoacyl-tRNA-Synthetasen so umprogrammieren, dass diese ihre tRNAs mit den jeweils gewünschten nichtnatürlichen AS beladen.
Die Forscher schleusten dieses veränderte Erbmaterial in Bakterienzellen ein. Wunschgemäß bauten diese daraufhin zwei verschiedene nichtnatürliche AS in ein Protein ein. Diese beiden AS sind so konstruiert, dass sie je einen spezifischen "Druckknopf" tragen, an den später nach Belieben funktionelle Molekülgruppen einfach "angeknüpft" werden können (Klick-Chemie). So lassen sich beispielsweise spezielle Molekülpaare anknüpfen, die fluoreszieren, wenn sie untereinander Energie austauschen können. Dazu müssen sie einen bestimmten Abstand und Winkel zueinander haben. Solche Paare ermöglichen Rückschlüsse auf die Konformation eines Proteins und auf dessen dynamische Veränderungen während einer Reaktion.
Zusatzinformationen:
Dr. Wei Wan, Ying Huang, Dr. Zhiyong Wang, Dr. William K. Russell, Dr. Pei-Jing Pai, Prof. David H. Russell, Prof. Wenshe R. Liu:
A Facile System for Genetic Incorporation of Two Different Noncanonical Amino Acids into One Protein in Escherichia coli.
In: Angewandte Chemie; Volume 122 Issue 18, Pages 3279 - 3282, 25. März 2010, DOI 10.1002/ange.201000465
Quelle: Angewandte Chemie, Pressemitteilung Nr. 13/2010
Aktualisiert am 28.04.2010.
Permalink: https://www.internetchemie.info/news/2010/apr10/den-genetischen-bauplan-erweitern.php
© 1996 - 2026 Internetchemie ChemLin