Ein Schlüssel passt in der Regel nur in ein bestimmtes Schloss. Ähnlich ist es bei Kohlenhydraten und Proteinen.
Auf der Oberfläche von Körperzellen sitzen unterschiedliche Kohlenhydrate, die als Erkennungsstellen für Proteine dienen. So werden die Blutgruppen durch verschiedene Kohlenhydrate auf der Oberfläche von roten Blutkörperchen bestimmt. Anhand der Wechselwirkung zwischen diesen Erkennungsstellen und Proteinen der Zellen des Immunsystems unterscheidet die körpereigene Abwehr zwischen eigener und fremder Blutgruppe.
Münstersche Chemiker haben nun erstmals kleine künstliche Proteine identifiziert, die hochselektiv an bestimmte Kohlenhydrat-Moleküle "andocken".
Solche "Mini-Proteine" könnten gezielt in die natürlichen Erkennungsprozesse im Organismus eingreifen und sind daher vielversprechende Wirkstoffe für diagnostische und therapeutische Zwecke, so die Wissenschaftler. Die Forschungsarbeit wurde von der führenden Fachzeitschrift "Angewandte Chemie" veröffentlicht und als "besonders wichtige Studie" eingestuft.
Immunzellen erkennen die Kohlenhydrate auf der Oberfläche von Viren und Bakterien. Auf der anderen Seite spielen die Wechselwirkungen von Kohlenhydraten und Proteinen auch beim Eindringen von Viren in die Wirtszellen eine Rolle. "Wir hoffen, dass man eines Tages mit 'Mini-Proteinen' gezielt in biologische Prozesse eingreifen und damit auch Krankheiten behandeln kann", so Prof. Dr. Bart Jan Ravoo vom Organisch-Chemischen Institut der Westfälischen Wilhelms-Universität Münster (WWU). "So könnte man das Eindringen von Viren in Körperzellen verhindern, indem man mit künstlichen Proteinen den Erkennungsmechanismus blockiert."
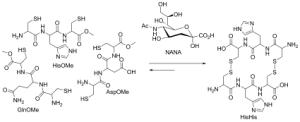
Die Münsteraner haben eine spezielle Methode entwickelt, mit der sie Kohlenhydrat-bindende Proteine identifizieren. Bei diesem sogenannten dynamisch-kombinatorischen Ansatz werden "Mini-Proteine" hergestellt und anschließend in einer Lösung mit verschiedenen Kohlenhydraten zusammengegeben. Die Kohlenhydrate verbinden sich dabei von selbst mit den passenden Proteinen. Diese "Pärchen" weisen die Chemiker durch chemische und spektroskopische Analyse nach.
Neben Prof. Dr. Bart Jan Ravoo sind Melanie Rauschenberg vom Organisch-Chemischen Institut sowie Dr. Susanne Bomke und Prof. Dr. Uwe Karst vom Institut für Anorganische und Analytische Chemie der WWU an der Studie beteiligt. Das Forschungsprojekt wird im Rahmen des neuen Sonderforschungsbereichs 858 "Synergetische Effekte in der Chemie - Von der Additivität zur Kooperativität" von der Deutschen Forschungsgemeinschaft gefördert.
Zusatzinformationen:
Melanie Rauschenberg, Dr. Susanne Bomke, Prof. Dr. Uwe Karst, Prof. Dr. Bart Jan Ravoo:
Dynamische Peptide als biomimetische Kohlenhydratrezeptoren.
In: online Veröffentlichung vom 26. August 2010; Angewandte Chemie, DOI 10.1002/ange.201002847
Quelle: Westfaelische Wilhelms-Universität, Münster
Aktualisiert am 31.08.2010.
Permalink: https://www.internetchemie.info/news/2010/aug10/biomimetische-kohlenhydratrezeptoren.php
© 1996 - 2026 Internetchemie ChemLin