Wassercluster bezeichnen Wassermoleküle, die sich kurzfristig zu größeren Molekülverbänden zusammenschließen. Diese Wassercluster können weitere positiv geladene Protonen aufnehmen und kommen dann als sogenannte protonierte Wassercluster auch etwa als funktionelle Gruppen in Proteinen vor. Mit Hilfe der Infrarotsprektroskopie lassen sich Bindungsstärke, die molekulare Geometrie und andere Eigenschaften protonierter Wassercluster bestimmen. Für die Messung der Schwingungsspektren sind Botenmoleküle nötig.
Ein Forscherteam um den LMU-Physiker Dr. Gerald Mathias und Professor Dominik Marx von der Ruhr-Universität Bochum, konnte nun erstmals nachweisen, wie diese Strukturen die Zuweisung der spektralen Banden bei der Infrarotspektroskopie beeinflussen. "Unsere Ergebnisse könnten dazu beitragen, solche Messungen besser zu verstehen", sagt Mathias. "Das ist wichtig, um beispielsweise die Funktion protonierter Wassercluster in Proteinen zu entschlüsseln. Weil Wassermoleküle praktisch überall vorkommen, könnten die verbesserten Messungen etwa auch bei chemischen Analysen der Erdatmosphäre oder in der Astrochemie zum Einsatz kommen."
Wassermoleküle sind nicht gern allein. Das verdanken sie einer chemischen Besonderheit: Ihre Atome tragen starke Ladungen, sodass sich benachbarte Wassermoleküle anziehen und über sogenannte Wasserstoffbrücken zu Ketten oder gar Clustern zusammenschließen. Darin sind die einzelnen Wassermoleküle nicht mehr frei beweglich, sondern stark gebunden. Deshalb benötigt das Verdunsten von Wasser, also der Übergang vom flüssigen in den gasförmigen Zustand, auch relativ viel Energie, um diese Bindungen zu brechen. Lagern sich zusätzlich Protonen an, also die positiv geladenen Atomkerne von Wasserstoff, so spricht man von protonierten Wasserclustern. Diese Strukturen sind wichtige Modellsysteme, um die Lösung von Protonen in Wasser zu untersuchen und so dessen pH-Wert und Leitfähigkeit zu verstehen.
Das kleinste protonierte Wassercluster ist das Hydronium-Kation: Es besteht nur aus einem einzelnen Wassermolekül und besitzt die chemische Struktur H3O+. Das Zundel-Ion ist mit einem Proton, das sich zwei Wassermoleküle teilen, dagegen deutlich komplexer. Mithilfe infrarotspektroskopischer Messungen lassen sich die Eigenschaften verschiedener Wassercluster bestimmen. Dabei werden in den Molekülen durch infrarotes Licht verschiedene Schwingungen angeregt, für welche die eingestrahlte Wellenlänge, also die Farbe des Lichts, jeweils charakteristisch ist. Daraus lassen sich dann Rückschlüsse auf die dreidimensionale Struktur des Moleküls und die Stärke der atomaren Bindungen ziehen.
Um die Schwingungsspektren der Wassercluster im gasförmigen Zustand messen zu können, benötigt man kleine Moleküle oder Edelgase wie Neon oder Argon als Boten, welche sich quasi als Spione an die Wassercluster anlagern und die Schwingungen detektieren. "Diese Spektren hängen aber von den Botenmolekülen ab, sodass diese Wechselwirkung bei der Interpretation der Ergebnisse berücksichtigt werden muss", sagt Dr. Gerald Mathias von der Fakultät für Physik der LMU München. Zusammen mit Forscherkollegen um Professor Dominik Marx von der Ruhr-Universität Bochum konnte er nun zeigen, dass bereits beim Hydronium-Kation durch den Einfluss der Botenmoleküle unerwartete Effekte bei den spektralen Banden auftreten. Mit Hilfe von Simulationen der Dynamik dieser Komplexe aus protonierten Wasserclustern und Botenmolekülen konnte das Team die tatsächlichen Spektren aber aus den Ergebnissen reproduzieren.
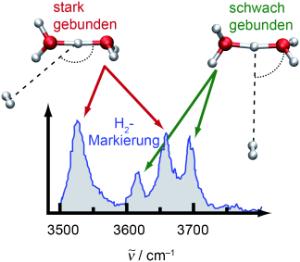
"Noch interessanter waren die Ergebnisse beim Zundel-Kation, das ständig seine Form ändert", sagt Mathias. "Wir konnten zeigen, dass diese Struktur in zwei verschiedenen Formen vorliegt. Im stark gebundenen Zustand lagern sich die Boten direkt an das Zundel-Kation an, beim schwach gebundenen Zustand umkreisen sie es nur. Im schwach gebundenen Zustand konnten wir aber nahezu dieselben Farbspektren beobachten wie beim ungebundenen Zundel-Kation - sodass die Spektren also nicht von den Botenmolekülen beeinflusst wurden." Dieses Ergebnis erlaubt nun ein besseres Verständnis der experimentellen Botenspektroskopie, die zur chemischen Analyse der Bestandteile der Erdatmosphäre oder des interstellaren Raumes im Weltall eingesetzt wird. Die Forscher erhoffen sich außerdem neue Rückschlüsse auf die Struktur und Funktion protonierter Wassercluster in Proteinen.
[CA/suwe]
Zusatzinformationen:
Gerald Mathias, Dominik Marx:
Structures and spectral signatures of protonated water networks in bacteriorhodopsin.
In: Proceedings of the National Academy of Sciences; PNAS, 24. April 2007, DOI 10.1073/pnas.0609229104
Marcel Baer, Dominik Marx, Gerald Mathias:
Theoretische Botenspektroskopie von mikrosolvatisierten Hydronium- und Zundel-Kationen.
In: Angewandte Chemie; online Veröffentlichung vom 23. August 2010, DOI 10.1002/ange.201001672
Quelle: Ludwig-Maximilians-Universität München, LMU
Aktualisiert am 25.08.2010.
Permalink: https://www.internetchemie.info/news/2010/aug10/protonierte-wassercluster-vermessen.php
© 1996 - 2026 Internetchemie ChemLin