Ethylen (Ethen, CH2=CH2) ist einer der wichtigsten Ausgangsstoffe für die chemische Industrie, vor allem für die Herstellung von Kunststoffen wie Polyethylen und Polystyrol. Ethylen wird derzeit durch Steamcracken von Erdölfraktionen hergestellt. Eine interessante Alternative könnte die Gewinnung von Ethylen aus Methan (CH4) darstellen. Denn während die Erdölvorräte langsam zur Neige gehen, ist Methan noch immer in riesigen Erdgas-Lagerstätten vorhanden. Das Problem: Die Kohlenstoff-Wasserstoff-Bindungen in Methan sind nur sehr schwer zu spalten. Um den Methan-Kohlenstoff dazu zu bringen, Bindungen mit ihresgleichen einzugehen, sind daher extreme Bedingungen nötig. Außerdem entsteht ein Produktgemisch.
Wissenschaftler um Thorsten M. Bernhardt von der Universität Ulm und Uzi Landman vom Georgia Institute of Technology (Atlanta, USA) haben jetzt einen Ansatz gefunden, wie sich Methan selektiv und bei niedrigen Drücken und Temperaturen zu Ethylen umsetzen lässt: Freie Golddimere katalysieren diese Reaktion, wie die Forscher in der Zeitschrift Angewandte Chemie berichteten [siehe unten].
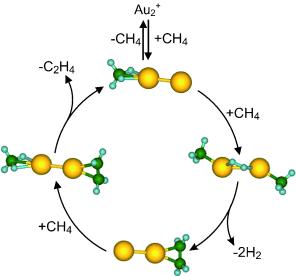
"Die Methanaktivierung, das heißt das Knacken von C-H-Bindungen, ist ein sehr komplexer Prozess," erklären die Wissenschaftler, "der zunächst auf molekularer Ebene geklärt werden muss, bevor sich praxistaugliche katalytische Prozesse entwickeln lassen." Um dies zu erforschen, führte das Team Experimente mit verschiedenen katalytischen Metallclustern (Anhäufungen weniger Metallatome) als Modellsystemen durch. Bei Tests mit Partikeln aus wenigen Gold-Atomen stellten sie fest, dass einfach positiv geladene Teilchen aus zwei Goldatomen (Au2+) in der Gasphase Methan selektiv zu Ethylen umsetzen können.
Anhand von Experimenten, bei denen Zwischenstufen der Reaktion "eingefangen" wurden, sowie Modellrechnungen waren die Wissenschaftler in der Lage, einen Reaktionsmechanismus für diesen katalytischen Zyklus zu formulieren. Vereinfacht dargestellt läuft er so: Je ein Goldatom des Golddimers bindet je ein Methanmolekül. Unter Abspaltung von Wasserstoff bilden die beiden Kohlenstoffatome der Methanmoleküle eine Einfach-Bindung untereinander aus. Diese Ethylen-Vorstufe bleibt zunächst an eines der Goldatome gebunden. Das nun freie Goldatom bindet ein frisches Methanmolekül. Im letzten Schritt verdrängt ein weiteres Methanmolekül die Ethylen-Vorstufe von ihrem Platz am Goldatom, Ethylen wird freigesetzt. Und der Reaktionszyklus kann von Neuem beginnen.
"Sowohl die Aktivierung der Kohlenstoff-Wasserstoff-Bindungen des Methans als auch die anschließende Abspaltung des Ethylenmoleküls erfordern ein kooperatives Zusammenwirken mehrerer an das Golddimer gebundener Moleküle," erläutern Bernhardt und Landman weitere Details des Mechanismus. "Unsere Erkenntnisse sind nicht nur von grundlegendem, sondern auch von möglichem praktischem Interesse."
Zusatzinformationen:
Dr. Sandra M. Lang, Prof. Dr. Thorsten M. Bernhardt, Dr. Robert N. Barnett, Prof. Dr. Uzi Landman:
Methanaktivierung und katalytische Ethylenbildung an freiem Au2+.
In: Angewandte Chemie; online veröffentlicht am 05. Januar 2010, DOI 10.1002/ange.200905643
Quelle: Angewandte Chemie, Presseinformation Nr. 03/2010
Aktualisiert am 19.01.2010.
Permalink: https://www.internetchemie.info/news/2010/jan10/methanaktivierung an gold.php
© 1996 - 2025 Internetchemie ChemLin