FRANKFURT - Die Proteine der Zellmembran entscheiden, was in unsere Zellen hinein gelangt und wieder heraus kommt. Sind sie defekt, treten schwerwiegende Krankheiten auf, die bisher nur unzulänglich behandelt werden können. Verglichen mit ihrer Bedeutung im Körper, ist bisher nur wenig über die Arbeitsweise von Membranproteinen bekannt.
Eine Arbeitsgruppe des Exzellenzclusters Makromolekulare Komplexe Frankfurt hat nun einen wichtigen Beitrag zur Aufklärung des Transportmechanismus für das zur Energiegewinnung wichtige Molekül Carnitin geleistet.
Die Ergebnisse ihrer Studien wurden in der renommierten Fachzeitschrift "Nature" veröffentlicht [siehe unten].
"Gemessen an den Schwierigkeiten, welche die Aufklärung von Membranprotein-Strukturen mit sich bringt, ist dies ein großer Erfolg", kommentiert Prof. Werner Kühlbrandt, Leiter der Arbeitsgruppe Strukturbiologie am Max-Planck-Institut für Biophysik in Frankfurt. "Denn jeder Transportmechanismus, der entschlüsselt wird, ist bei der Interpretation von Strukturdaten, die wir auch von vergleichbaren Proteinen gewinnen, nützlich." Das jetzt aufgeklärte Transportprotein schleust einerseits Carnitin in die Zelle ein und entsorgt anderseits Stoffwechselprodukte aus der Zelle nach außen. Carnitin wird in menschlichen Zellen benötigt, um aus dem Fettstoffwechsel Energie zu gewinnen.
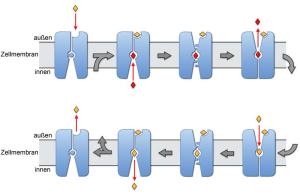
Um die Funktion dieser medizinisch und pharmakologisch wichtigen Transporterproteine dieser Faltungsart im molekularen Detail zu verstehen, benötigt man von jeder Etappe des Transports eine strukturelle Momentaufnahme. Sabrina Schulze hat im Rahmen ihrer Doktorarbeit zwei dieser neuen Momentaufnahmen durch die beiden hochaufgelösten Strukturen des Carnitin-Transporters geliefert. Diese beiden Strukturen zeigen den Carnitin-Transporter mit und ohne Substrat zum Zellinneren hin geöffnet. "Sabrina Schulze hat durch ihre Arbeit einen bedeutenden Beitrag zum Verständnis des Molekültransports über die Zellmenbran geleistet. Insgesamt konnten in der Arbeitsgruppe von Prof. Kühlbrandt bereits drei der Hauptkonformationen dieser wichtigen Transporterproteine aufgeklärt werden." erklärt Dr. Christine Ziegler, die im vergangenen Jahr durch die Röntgenkristallstruktur eines verwandten Betain-Transporters eine zum Zellinneren geschlossene Konformation beschreiben konnte.
Bis zur klinischen Anwendung dieser Ergebnisse ist es noch ein weiter Weg. "Bisher wissen wir immer noch relative wenig über die Funktionsweise dieser Art von Membranproteinen. Es ist schwierig, diese Transporterproteine in eine geordnete kristalline Form zu überführen, die dann mit Röntgenstrahlen untersucht werden können um die hochaufgelöste Struktur zu erhalten", erklärt Sabrina Schulze. Das liegt unter anderem daran, dass diese dynamischen Makromoleküle ein wasser- und ein fettlösliches Ende besitzen und deshalb zum einen schwer aus der natürlichen Zellmembran zu isolieren sind und zum zweiten häufig außerhalb der Membranschicht instabil werden. Oft sind die Kristalle, die man trotz dieser Schwierigkeiten manchmal erhält, nur sehr klein. Um dennoch verlässliche Daten über die Struktur des Membranproteins zu gewinnen, benötigt man Röntgenstrahlen von hoher Brillanz, wie sie etwas an der europäischen Synchrotron-Strahlungsquelle (ESRF) in Grenoble (Frankreich) oder an der schweizerischen Synchrotron-Strahlungsquelle (SLS) in Villigen erzeugt wird. Von allen bisher aufgeklärten Proteinstrukturen gehören nur 0,5 Prozent zu den Membranproteinen. Ihre Bedeutung wird aber deutlich, wenn man sich vor Augen führt, dass schätzungsweise 20 bis 30 Prozent der Gene in unserem Körper Baupläne für Proteine in der Zellmembran enthalten.
Zusatzinformationen:
Sabrina Schulze, Stefan Köster, Ulrike Geldmacher, Anke C. Terwisscha van Scheltinga, Werner Kühlbrandt:
Structural basis of Na+-independent and cooperative substrate/product antiport in CaiT.
In: Nature; 467, 233-236, 09. September 2010, DOI 10.1038/nature09310
Quelle: Goethe-Universität, Frankfurt am Main
Aktualisiert am 01.10.2010.
Permalink: https://www.internetchemie.info/news/2010/oct10/carnitin-transporter.php
© 1996 - 2026 Internetchemie ChemLin