Multiresistente Keime sind in Kliniken ein großes Problem, weil viele Erreger inzwischen unempfindlich gegen Antibiotika geworden sind. Wissenschaftler suchen deshalb fieberhaft nach neuen Wirkstoffen. Ein Forscherteam unter Federführung der Universitäten Bonn, Düsseldorf und Newcastle hat nun die Wirkweise eines neuartigen Antibiotikums entschlüsselt, das selbst multiresistente Keime abtötet. Die Ergebnisse sind jetzt in den Proceedings of the National Academy of Sciences USA (PNAS) erschienen [siehe unten].
Gefährliche bakterielle Infektionen wie eine Lungenentzündung oder eine Tuberkulose sind in der Regel mit Antibiotika gut in den Griff zu bekommen. "Allerdings sind so genannte multiresistente Keime auf dem Vormarsch", berichtet Erstautor Dr. Peter Sass vom Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie der Universität Bonn. "Bewährte Substanzen entfalten oft nicht mehr ihre Wirkung, weil die Bakterien gegen diese Waffen unempfindlich geworden sind." In ihren Laboren suchen Forscher weltweit deshalb nach neuen Antibiotika, um gefährliche Infektionskrankheiten zu bekämpfen.
So auch Dr. Sass, der zu einer gemeinsamen Forschergruppe der Universitäten Bonn und Düsseldorf gehört, die von der Deutschen Forschungsgemeinschaft gefördert wird. "Wir haben bereits in verschiedenen Studien gezeigt, dass so genannte Acyldepsipeptide gegen grampositive Bakterien wirken, darunter auch der gefürchtete human-pathogene und multiresistente Erreger Staphylococcus aureus, sagt Projektleiterin Prof. Dr. Heike Brötz-Oesterhelt vom Institut für Pharmazeutische Biologie der Universität Düsseldorf. "Allerdings war bislang unbekannt, wo genau diese Substanzen angreifen und ihre antibiotische Wirkung entfalten."
Neues Antibiotikum führt zur Fehlsteuerung eines wichtigen Enzyms
Während herkömmliche Antibiotika normalerweise bestimmte Reaktionen in Bakterienzellen hemmen, greifen die Acyldepsipeptide (ADEPs) an einer ganz anderen Schlüsselstelle in den Stoffwechsel der Bakterien ein. Sie führen zu einer Fehlsteuerung eines wichtigen Enzyms. "Diese ClpP-Protease bewirkt normalerweise das Recycling von defekten Proteinen des Bakteriums, welches ein ganz strikt kontrollierter Prozess ist", berichtet Prof. Brötz-Oesterhelt. "Die ADEPs setzen diese strikte Kontrolle der ClpP-Protease außer Kraft, wodurch nun auch bestimmte gesunde Proteine abgebaut werden", sagt Dr. Sass. "Die Bakterien begehen regelrecht Selbstmord, da die eigene ClpP-Protease nun das für die Zellteilung wichtige FtsZ-Protein zerschneidet und verdaut." Dadurch gerät die normale Steuerung außer Rand und Band, die Zellteilung und dadurch die Vermehrung der Erreger wird verhindert.
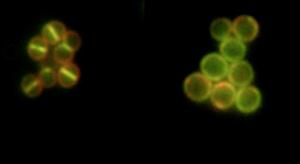
Die Wissenschaftler nutzten für ihre Untersuchungen eine auf ihrem Forschungsgebiet neue Methode aus der Grundlagenforschung. Dr. Sass machte am Zentrum für Bakterielle Zellbiologie an der Universität Newcastle (England) mit einem extrem hoch auflösenden Fluoreszenzmikroskop Aufnahmen von Bakterien. "Wir markierten das FtsZ-Protein und viele weitere Proteine in den Bakterien mit einem grün fluoreszierenden Farbstoff und machten dann Echtzeitaufnahmen von den mit ADEPs behandelten und auch von unbehandelten Erregern", berichtet Dr. Sass. Durch diesen Vergleich konnten die Forscher beobachten, was im Stoffwechsel der gefährlichen Bakterien anders lief, wenn sie mit dem neuartigen Antibiotikum behandelt waren. "Nach der Gabe von ADEP gelangten im Bakterium wichtige Proteine nicht mehr zu der Stelle im Stoffwechsel, wo sie für die Zellteilung gebraucht werden", ergänzt Prof. Brötz-Oesterhelt.
Wirkung gegen mehrere gefährliche Bakterienarten
Das neuartige Antibiotikum wirke nicht nur gegen den gefürchteten multiresistenten Erreger Staphylococcus aureus (MRSA), sondern auch gegen Streptokokken, die etwa Mittelohr-, Lungen-, oder Hirnhautentzündungen auslösen können, so die Forscher. Außerdem stoppt es die Vermehrung von Enterokokken, die zum Beispiel für Harnwegsinfekte, Blutvergiftung oder eine Entzündung der Herzinnenhaut verantwortlich gemacht werden. "Die ADEPs befinden sich allerdings zurzeit noch im Stadium der Grundlagenforschung", erklärt Prof Brötz-Oesterhelt. In der Regel benötigt eine Substanz noch etwa acht bis zehn Jahre, um von diesem Stadium bis zur Markteinführung zu gelangen. "Allerdings sehen wir in den ADEPs noch mehr als ein neues Antibiotikum zur Bekämpfung von Infektionskrankheiten. Da sie gegen Bakterien mit Hilfe eines neuartigen Mechanismus wirken, können sie uns auch helfen, die Lebensweise der Bakterien besser zu verstehen", meint Dr. Sass. "Wir müssen wissen, wie pathogene Bakterien ticken, damit wir sie erfolgreich bekämpfen können."
Zusatzinformationen:
Peter Sass, Michaele Josten, Kirsten Famulla, Guido Schiffer, Hans-Georg Sahl, Leendert Hamoen und Heike Brötz-Oesterhelt:
Antibiotic acyldepsipeptides activate ClpP peptidase to degrade the cell division protein FtsZ.
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 03. Oktober 2011, DOI 10.1073/pnas.1110385108
Quelle: Rheinische Friedrich-Wilhelms-Universität, Bonn
Aktualisiert am 04.10.2011.
Permalink: https://www.internetchemie.info/news/2011/oct11/acyldepsipeptid-antibiotika.php
© 1996 - 2026 Internetchemie ChemLin