RUB-Forscher vom Lehrstuhl für Biophysik haben eine neue Methode zur detaillierten Untersuchung der Interaktion von Medikamenten mit ihren Zielproteinen entwickelt.
Die Pharmaindustrie ist schon auf die neue Infrarotspektroskopie-Technik aufmerksam geworden: Im EU-Projekt K4DD, das zur Hälfte von namhaften europäischen Pharmafirmen getragen wird, soll die Methode zur Untersuchung von Wirkstoff-Protein-Interaktionen eingesetzt werden.
"Wir haben jetzt ein Werkzeug in der Hand, um die Dynamik pharmakologisch interessanter Proteine im atomaren Detail zu erforschen", sagt Prof. Dr. Klaus Gerwert. "Wir wollen Substanzbibliotheken gezielt nach potenziellen pharmakologischen Wirkstoffen durchsuchen."
"Mit unserer Technik können zukünftige Medikamente genauer auf die Proteine abgestimmt werden, was die Nebenwirkungen erheblich reduzieren kann", ergänzt PD Dr. Carsten Kötting. Zusammen mit Dr. Jörn Güldenhaupt und Philipp Pinkerneil beschreiben sie die neue Methode im Fachjournal "ChemPhysChem", das dem Thema die Titelgeschichte widmete.
Die neue Methode: Aus drei mach eins
Mit der Infrarot-Differenz-Spektroskopie verfolgen Forscher dynamische Vorgänge in Proteinen. Das war bislang nur bei licht-aktivierten Proteinen möglich, aber nicht bei Proteinen, die durch Interaktion mit Bindungspartnern aktiviert werden - genau das ist aber gerade bei vielen krankheitsrelevanten Molekülen der Fall. Um die Dynamik dieser Proteine zu analysieren, müssen sie fest an der Messoberfläche verankert sein und mit den pharmakologischen Wirkstoffen überspült werden, mit denen sie interagieren. Eine solche Verankerung ist zwar möglich, konnte jedoch nicht für jedes beliebige Protein realisiert werden.
Dieses Problem umging das RUB-Team, indem es die Infrarot (IR)-Spektroskopie mit einer oberflächensensitiven Technik (Abgeschwächter Totalreflexion) und sogenanntem "His-Tagging" (Verankerung an dieser Oberfläche) kombinierte.
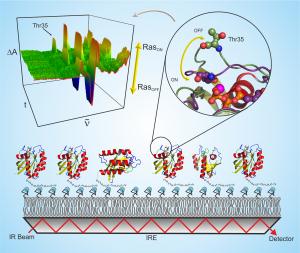
Abgeschwächte Totalreflexion: den Infrarotstrahl zu allen Proteinen bringen
Bei der herkömmlichen IR-Spektroskopie wird Infrarot-Licht auf eine wässrige Probe eingestrahlt; ein Teil des Lichtes wird von den Proteinen absorbiert, was Rückschlüsse auf ihre Struktur erlaubt. Die RUB-Forscher strahlten das Infrarot-Licht nun durch einen Germanium-Kristall ein, an dessen Oberfläche die Proteine gebunden werden. An den Grenzflächen des Kristalls wird das Licht immer wieder reflektiert und breitet sich so durch den Kristall aus (Abgeschwächte Totalreflexion). Dabei tritt ein Teil der Lichtwellen aus dem Kristall aus und erreicht so die an der Oberfläche gebundenen Proteine. Eine ähnliche Technik, die "Surface Plasmon Resonanz" wird heute standardmäßig in der Pharmaindustrie eingesetzt, hat aber nicht die atomare Auflösung der neuen Technik.
An die Kette gelegt: das His-Tag
Diese Bindung erfolgte über das His-Tag, eine einfache Aminosäurekette, die heute standardmäßig an Proteine angehangen wird, um sie biochemisch zu untersuchen - quasi ein Universaladapter. Über diesen Anker dockten die RUB-Forscher die Proteine am Germanium-Kristall an. So lagen die Moleküle fest gebunden an einer Oberfläche vor, die das Infrarot-Licht für die Messung über abgeschwächte Totalreflexion zuführte. Der große Vorteil: Eine Fülle von Proteinen ist bereits mit His-Tag ausgestattet, ist also problemlos mit der neuen Bochumer Kombinationsmethode analysierbar. Auch jedes weitere Protein, an das eine His-Kette angehangen wird, ist nun der IR-Spektroskopie zugänglich. "Das wird helfen, eine Vielzahl von biologischen und medizinischen Fragen zu beantworten", so Gerwert.
Methodenetablierung am Schalterprotein Ras
Als Erstes erprobte das RUB-Team die neue Methode am Protein Ras, dem zentralen Ein/Aus-Schalter des Zellwachstums. Defektes, sogenanntes onkogenes Ras, ist einer der häufigsten Auslöser von Krebs. Den Forschern gelang es, Ras mit dem His-Tag erfolgreich an die Messoberfläche zu binden und dieses an die Kette gelegte Ras durch einen Bindungspartner zu aktivieren. "Die Technik ist derart empfindlich, dass wir das Signal von einer nur fünf Nanometer dicken Proteinschicht auflösen konnten. Das entspricht circa 1/10000 des Durchmessers eines menschlichen Haares", so RUB-Forscher Dr. Jörn Güldenhaupt, der maßgeblich an der Entwicklung der Methode beteiligt war. Auch kleinste Strukturänderungen beim Übergang zwischen den beiden Schalterstellungen des Ras-Proteins waren mit dem "Protein-Nanoskop" zu erkennen.
Projektförderung
Fördermittel für das Projekt stammen vom Protein Research Department der RUB, vom Land NRW im Rahmen des Centers for Vibrational Microscopy (CVM) und vom SFB 642 "GTP- und ATP-abhängige Membranprozesse", dessen Sprecher Prof. Gerwert ist.
Zusatzinformationen:
Philipp Pinkerneil, Dr. Jörn Güldenhaupt, Prof. Dr. Klaus Gerwert, Dr. habil. Carsten Kötting:
Surface-Attached Polyhistidine-Tag Proteins Characterized by FTIR Difference Spectroscopy.
In: ChemPhysChem; Volume 13, Issue 11, pages 2649–2653, 06. August 2012, DOI 10.1002/cphc.201200358
Quelle: Ruhr-Universität, Bochum, RUB
Aktualisiert am 31.08.2012.
Permalink: https://www.internetchemie.info/news/2012/aug12/protein-pharmaka-interaktion.php
© 1996 - 2026 Internetchemie ChemLin