Wer bei Amalgam nur an Zahnfüllungen denkt, dem entgeht etwas: Amalgame, Legierungen des Quecksilbers mit anderen Metallen, werden bereits seit mehr als 2500 Jahren in der Schmuckherstellung und im Bergbau zur Extraktion von Metallen wie Silber und Gold genutzt.
Heute ist der gegenteilige Prozess interessanter: Das Entfernen von Quecksilber aus Abwässern durch Amalgamierung mit Edelmetallen - in Form von Nanopartikeln.
Kseniia Katok und Kollegen stellen in der Zeitschrift Angewandte Chemie jetzt neue Erkenntnisse vor:
Werden die Durchmesser von Silbernanopartikeln noch weiter verringert, lässt sich wesentlich mehr Quecksilber pro eingesetztem Silber extrahieren.
Im konventionellen Fall reagieren bei der Quecksilberentfernung zwei Silberatome mit jeweils einem zweifach positiv geladenen Quecksilberion aus dem Abwasser zu zwei Silberionen, die nun ihrerseits in Lösung gehen, und einem neutralen Quecksilberatom, das vom metallischen Silberpartikel aufgenommen wird. Das stöchiometrische Verhältnis von Quecksilber zu Silber beträgt also 1:2.
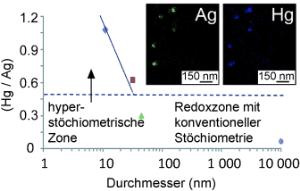
Die Forscher von der Universität Brighton (Großbritannien) sowie Kollegen aus Kasachstan, Frankreich und Japan haben nun festgestellt, dass sich die Stöchiometrie der Reaktion ändert, wenn die Silbernanopartikel einen kritischen Durchmesser von 32 nm unterschreiten. Der Effekt, "Hyperstöchiometrie" genannt, ist von der Größe der Nanopartikel abhängig. Bei Partikeln mit Durchmessern um 10 nm wird ein Verhältnis von 1,1:1 bis 1,7:1 erreicht - je nachdem, mit welchem Gegenion die Quecksilberionen auftreten. Die Reaktion läuft dabei offenbar anders als bei 'normal' großen Silberpartikeln: Die Forscher vermuten, dass die zunächst entstehenden Silberionen an die Silbernanopartikel adsorbieren und dort, unter dem katalytischen Einfluss der winzigen Silbernanopartikel, von negativ geladenen Gegenionen der Quecksilbersalze (z. B. Nitrat oder Acetat), wieder zu elementarem Silber "recycelt" werden. Es ist ein häufig beobachtetes Phänomen, dass sehr kleine Nanopartikel stärkere katalytische Aktivität zeigen als größere, da bei ihnen Oberflächeneigenschaften über die Feststoffeigenschaften dominieren. Der hyperstöchiometrische Effekt verspricht neue Ansätze für die Reinigung von Abwässern sowie die Katalyse.
Zur Herstellung der benötigten extrem kleinen Silbernanopartikel statten die Wissenschaftler eine Siliciumdioxid-Oberfläche mit einzelnen Siliciumwasserstoffgruppen (-SiH) aus. Diese vermögen Silberionen zu neutralen Silberatome zu reduzieren, die an die Oberfläche gebunden werden und vermutlich als 'Kristallisationskeime' für das weitere Aufwachsen von Silber dienen. So entstehen fixierte Nanopartikel, die nicht aggregieren können. Anhand der Dichte der SiH-Gruppen und der Reaktionszeit lässt sich die Größe der Partikel kontrollieren. Anders als bei herkömmlichen Verfahren werden keine Stabilisatoren benötigt, die an den Silbernanopartikel haften bleiben und deren physikochemische Eigenschaften verändern.
Kseniia Katok arbeitet als Marie Curie International Incoming Fellow an der Universität Brighton (Großbritannien) in der Nanoscience & Nanotechnology Group. Ihre Spezialgebiete sind die Chemie von Silicium und Kohlenstoff und die Entwicklung von innovativen Materialien für Anwendungen im Umwelt- und biomedizinischen Sektor.
Zusatzinformationen:
Dr. Kseniia V. Katok, Dr. Raymond L. D. Whitby, Dr. Takahiro Fukuda, Prof. Toru Maekawa, Dr. Igor Bezverkhyy, Prof. Sergey V. Mikhalovsky, Prof. Andrew B. Cundy:
Hyperstoichiometric Interaction Between Silver and Mercury at the Nanoscale.
In: Angewandte Chemie; online veröffentlicht am 03. Februar 2012, DOI 10.1002/ange.201106776
Quelle: Angewandte Chemie, Presseinformation Nr. 06/2012
Aktualisiert am 15.02.2012.
Permalink: https://www.internetchemie.info/news/2012/feb12/hyperstoechiometrie-silber-quecksilber.php
© 1996 - 2026 Internetchemie ChemLin