Viele chemische Reaktionen auf der Erde fänden nicht statt, würden sie nicht durch Katalysatoren unterstützt. In lebenden Organismen übernehmen Enzyme die Rolle der Biokatalysatoren.
Enzyme sind so effektiv, weil sie die Reaktionspartner in Hohlräumen verkapseln, in denen die Reaktion ungestört stattfinden kann.
Forscher der Jacobs University, der Jyväskylä University in Finnland und weiterer Institutionen haben nun Erkenntnisse über die Rolle der Größe der molekularen Hohlräume für eine reibungslose chemische Reaktion gewonnen.
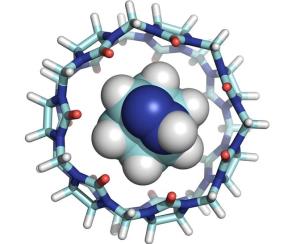
In Nature Chemistry stellen die Wissenschaftler ihre Ergebnisse vor. Eine Illustration ihrer Forschung wird auf dem Titelbild des Wissenschaftsjournals präsentiert [siehe unten].
"Ich freue mich sehr, dass Nature Chemistry sich dazu entschieden hat, eine Illustration unsere Studie auf dem Titelbild der Maiausgabe zu zeigen", sagt Khaleel Assaf, wissenschaftlicher Mitarbeiter an der Jacobs University und Co-Autor der Publikation. "Ein wesentlicher Schritt war es, sich die Reaktionen nicht in einer Lösung anzuschauen, sondern sie isoliert in der Gasphase mit Hilfe von Massenspektrometrie zu untersuchen."
Die Wissenschaftler analysierten diverse Reaktionen bei denen ein Molekül sich in mehrere kleinere aufspaltet und beobachteten, wie sich die Effizienz der Reaktion verändert, wenn man sie in molekularen Containern verschiedener Größen stattfinden lässt. Die molekularen Container simulieren dabei die sogenannte Bindungstasche eines Enzyms. Es wurden Container drei verschiedener Größen getestet und die Forscher konnten zeigen, dass der Container mittlerer Größe die chemischen Reaktionen am effektivsten fördert.
Mit quantenmechanischen Rechnungen, Modellen, die alle schwachen Kräfte zwischen den Molekülen berücksichtigen und Untersuchungen der Beweglichkeit von Ionen, konnten die Forscher die Erkenntnisse präzisieren: "In den kleinen Hohlräumen ist nicht genug Platz dafür, dass sich die Bindungen des Moleküls dehnen und dann schließlich brechen. Und in den großen Hohlräumen ist die Distanz zwischen dem reagierenden Molekül und den Wänden des Hohlraums zu groß, sodass attraktive Wechselwirkungskräfte, die eine Reaktion begünstigen, keine Rolle spielen. In den mittleren Hohlräumen hingegen ist genügend Platz für das Brechen der Molekülbindungen und die Hohlraumwände stabilisieren den Übergangszustand der Reaktion und sorgen somit für einen reibungslosen und effektiven Reaktionsablauf", erklärt Alexandra Lazar, wissenschaftliche Mitarbeiterin an der Jacobs University.
"Unser Ziel ist es, die Ergebnisse, die wir in der Gasphase erreicht haben, auch in Lösung zu wiederholen, da die zugrunde liegenden Prinzipien für alle Phasen gelten sollten, genauso wie für viele verschiedene chemische Reaktionen", so Werner Nau, Professor für Chemie an der Jacobs University, der neben Elina Kalenius von der University of Jyväskylä Hauptautor der Studie ist.
Die Ergebnisse sind von wesentlicher Bedeutung für das Verständnis von chemischen Reaktionen in Hohlräumen, sie sind von Relevanz für die Katalyse in Nanoreaktoren und tragen dazu bei, die Funktionsweise von Enzymen zu verstehen.
An der Studie beteiligte Institutionen
- Jacobs University, Deutschland,
- University of Jyväskylä, Finnland,
- University of Eastern Finland, Finnland,
- University of Cambridge, UK,
- Unilver, Niederlande.
Zusatzinformationen:
Tung-Chun Lee, Elina Kalenius, Alexandra I. Lazar, Khaleel I. Assaf, Nikolai Kuhnert, Christian H. Grün, Janne Jänis, Oren A. Scherman, Werner M. Nau:
Chemistry inside molecular containers in the gas phase.
In: Nature Chemistry; 5, 376 - 382, 07. April 2013, DOI 10.1038/NCHEM.1618
Quelle: Jacobs Universität, Bremen
Aktualisiert am 23.04.2013.
Permalink: https://www.internetchemie.info/news/2013/apr13/hohlraum-katalyse.php
© 1996 - 2026 Internetchemie ChemLin