Annette Rompel und ihr Team vom Institut für Biophysikalische Chemie der Universität Wien erforschen die "Bräunungsreaktion" beim Verderb von Champignons. Die ForscherInnen konnten nachweisen, dass das dafür zuständige Enzym bereits gebildet wird, wenn der Pilz noch gar nicht verdorben ist. Die Studie erschien online in den renommierten Fachjournalen Phytochemistry und Acta Crystallographica [siehe Artikel-Hinweis unten].
Das Verständnis der Wirkungsweise des Pigmentierung-Enzyms Tyrosinase ist sowohl von medizinischem, als auch technologischem Interesse. Das Kupfer enthaltende Enzym gilt bei Tieren und Menschen als unentbehrlich für den Schutz vor UV-Strahlung und liefert zugleich auch Informationen zur Verhinderung des Verderbs von Lebensmitteln. Champignons sind dabei aufgrund ihrer niedrigen Kosten und der guten Verfügbarkeit eine wertvolle Quelle für die WissenschafterInnen. Vor allem wegen ihres hohen Enzymgehaltes werden die Pilze für Untersuchungen an der Tyrosinase geschätzt.
Die Champignons dienen daher auch als Modellorganismus zur Untersuchung von Bräunungsreaktionen.
Bildung in inaktiver Vorstufe
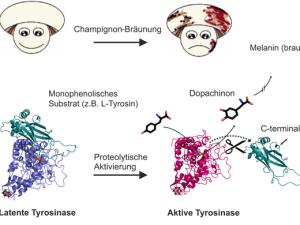
Seit 2012 ist bekannt, dass sechs verschiedene Tyrosinasen (PPO1 bis 6) im Champignon existieren, von denen zwei in größeren Mengen vorkommen (PPO3 und PPO4). Das für die Bräunungsreaktion verantwortliche Enzym wird dabei in sogenannten Eukaryoten (Lebewesen, die einen Zellkern besitzen) in einer inaktiven Vorstufe des Entwicklungsprozesses gebildet. Diese Vorstufe wird dann durch eine Spaltung aktiviert. Dabei wird der das aktive Zentrum abdeckende Teil des Enzyms entfernt und die Substrate (Tyrosin und andere Monophenole) können umgesetzt werden.
Neuer Isolierungsweg und eine außergewöhnliche Reagenz führten zum Erfolg
Keiner der bis dahin in der Literatur bekannten Isolierungswege konnte für PPO4 erfolgreich angewendet werden. Im Institut für Biophysikalische Chemie wurde nun eine Methode entwickelt, die es erstmals erlaubt, die latente Tyrosinase aus deren natürlicher Quelle zu isolieren. Die Enzym-Charakterisierung fand in enger Zusammenarbeit mit dem Massenspektrometriezentrum der Universität Wien der Fakultät für Chemie unter der Leitung von Andreas Rizzi statt.
Nachdem genügend große Mengen von reinem PPO4 extrahiert werden konnten, gelang es den WissenschafterInnen, Kristallisationsbedingungen zu finden und zu optimieren, unter denen das Protein Einkristalle bildet. Dieses gelang nur unter dem Einsatz eines relativ außergewöhnlichen Co-Kristallisation Reagenz, einem Polyoxometallat des Anderson-Typs.
Wesentlich für Medizin und Biotechnologie
Der Dissertant Stephan Mauracher hat das Projekt im Rahmen des Initiativkollegs "Functional Molecules" der Universität Wien bearbeitet. "Es ist gelungen, das Enzym in ausreichender Menge zu reinigen und zu charakterisieren. Ulrich Kortz von der Jacobs University Bremen hat das Polyoxometallat synthetisiert und als Additiv für die Proteinkristallisation vorgeschlagen. Das Forschungsvorhaben wurde sodann als FWF Einzelprojekt weiter geführt. So gelang die Kristallisation und die drei-dimensionale Strukturlösung von PPO4", so Rompel abschließend.
Die Universität Wien ist eine der ältesten und größten Universitäten Europas: An 15 Fakultäten und vier Zentren arbeiten rund 9.700 MitarbeiterInnen, davon 6.900 WissenschafterInnen. Die Universität Wien ist damit auch die größte Forschungsinstitution Österreichs sowie die größte Bildungsstätte: An der Universität Wien sind derzeit rund 92.000 nationale und internationale Studierende inskribiert. Mit über 180 Studien verfügt sie über das vielfältigste Studienangebot des Landes. Die Universität Wien ist auch eine bedeutende Einrichtung für Weiterbildung in Österreich. 1365 gegründet, feiert die Alma Mater Rudolphina Vindobonensis im Jahr 2015 ihr 650-jähriges Gründungsjubiläum.
Zusatzinformationen:
Stephan G. MauracherChristian Molitor, Claudia Michael, Martin Kragl, Andreas Rizzi, Annette Rompel:
High level protein-purification allows the unambiguous polypeptide determination of latent isoform PPO4 of mushroom tyrosinase.
In: Phytochemistry; Volume 99, Pages 14–25, veröffentlicht im März 2014, DOI 10.1016/j.phytochem.2013.12.016
S. G. Mauracher, C. Molitor, R. Al-Oweini, U. Kortz und A. Rompel:
Crystallization and preliminary X-ray crystallographic analysis of latent isoform PPO4 mushroom.
In: Acta Crystallographica Section F; Volume 70, Part 2, Februar 2014, DOI 10.1107/S2053230X14000582
S. G. Mauracher, C. Molitor, R. Al-Oweini, U. Kortz and A. Rompel:
Latent and active abPPO4 mushroom tyrosinase cocrystallized with hexatungstotellurate(VI) in a single crystal.
In: Acta Crystallographica Section D; Volume 70, Part 9, veröffentlicht im September 2014, DOI 10.1107/S1399004714013777
Quelle: Universität Wien, Österreich
Aktualisiert am 12.09.2014.
Permalink: https://www.internetchemie.info/news/2014/sep14/champignons-braunfaerbung.php
© 1996 - 2026 Internetchemie ChemLin