Sulfite sind schwefelhaltige Substanzen, die natürlich vorkommen und schon in geringer Konzentration giftig auf viele Lebewesen wirken. Außerdem werden Sulfite sowie Schwefeldioxid beispielsweise Wein und Trockenfrüchten beigemischt: Die Zusatzstoffe hemmen unerwünschte Mikroorganismen und machen die Produkte haltbarer.
Ein Team mit dem Freiburger Biochemiker Prof. Dr. Oliver Einsle und der Biochemikerin Dr. Bianca Hermann sowie Forscherinnen und Forschern der Technischen Universität Darmstadt hat ein bakterielles Enzym charakterisiert, das Sulfit bis zu einhundertmal schneller reduziert als bislang bekannte Enzyme. Die Wissenschaftlerinnen und Wissenschaftler klärten die hochaufgelöste Kristallstruktur des Enzymkomplexes MccA sowie molekulare Details des Reaktionsmechanismus auf. Ihre Ergebnisse verdeutlichen, warum MccA Sulfit so schnell umsetzen kann.
Zukünftig könnte dies den Einsatz des Enzyms in der Biotechnologie voranbringen: Mit maßgeschneiderten Mikroorganismen, die zur schnellen Sulfit-Reduktion fähig sind, wäre beispielsweise eine Entschwefelung unter milden Bedingungen möglich. Die Forschungsergebnisse wurden in der Fachzeitschrift "Nature" veröffentlicht [siehe Literatur-Hinweis unten].
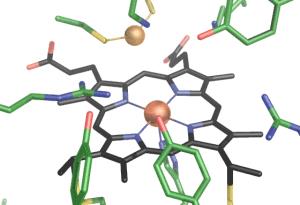
Einige Bakterien nutzen Sulfit im Energiestoffwechsel: Sie können dieses bei der Atmung verwenden, wenn kein Sauerstoff zur Verfügung steht. Die Bakterien gewinnen Energie, indem sie Sulfit bis hin zum Sulfid reduzieren und bei diesem Vorgang alle Sauerstoff-Atome abspalten. Zu den Bakterien, die diese Sulfit-Atmung nutzen, gehört Wolinella succinogenes, das sich im Pansen von Wiederkäuern findet und MccA produziert. MccA ist ein Metalloprotein: Es besitzt 24 Hämgruppen mit Eisen-Ionen. Darüber hinaus besteht es aus drei Untereinheiten, ist also ein Trimer.
Die von den Wissenschaftlern entschlüsselte Struktur des Enzyms zeigt ein bisher unbekanntes aktives Zentrum der Sulfit-Reduktion, gebildet durch eine der Hämgruppen in Kombination mit einem Kupfer-Ion. Das Kupfer-Ion wird über zwei Cystein-Reste gebunden, eine schwefelhaltige Aminosäure. Die Position des Kupfer-Ions verhindert dabei, dass sich ein Sulfit-Ion an das Enzym bindet. Stattdessen bindet Schwefeldioxid, das formal ein Wassermolekül weniger besitzt, an das aktive Zentrum. Das kleinere Molekül benötigt sozusagen weniger Platz. Dieser erste Schritt unterscheidet den Reduktionsmechanismus von MccA von anderen Enzymen, die Sulfit abbauen. Durch weitere Wasserabspaltungen reduziert MccA das Schwefeldioxid zum Endprodukt Sulfid. Die Forscher konnten in dem Strukturmodell des Enzyms Schwefeldioxid sowie Schwefelmonoxid nachweisen, wodurch sie auf diesen neuartigen Mechanismus schlossen.
Einsle leitet die Arbeitsgruppe Membran- und Metalloproteine am Institut für Biochemie der Albert-Ludwigs-Universität und ist assoziiertes Mitglied des Freiburger Exzellenzclusters BIOSS Centre for Biological Signalling Studies. Hermann ist Postdoktorandin in Einsles Arbeitsgruppe am Institut für Biochemie.
Zusatzinformationen:
Bianca Hermann, Melanie Kern, Luigi La Pietra, Jörg Simon und Oliver Einsle:
The octahaem MccA is a haem c-copper sulfite reductase.
In: Nature; online veröffentlicht am 02. Februar 2015, DOI 10.1038/nature14109
Quelle: Albert-Ludwigs-Universität, Freiburg im Breisgau
Aktualisiert am 25.02.2015.
Permalink: https://www.internetchemie.info/news/2015/feb15/mcca-sulfit-reduktion.php
© 1996 - 2026 Internetchemie ChemLin