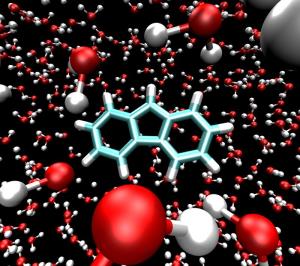
Als 'Antiaromaten' bezeichnen die Chemiker eine Art von Ringmolekülen, die extrem instabil sind - das Gegenstück zu den sehr stabilen aromatischen Molekülen. Weil sie nur Bruchteile von Sekunden existieren, braucht man extrem aufwendige, ultraschnelle Verfahren um sie nachzuweisen.
Forschern des Exzellenzclusters RESOLV an der Ruhr-Universität Bochum ist es jetzt mit Kollegen des Max Planck Instituts für Kohlenforschung in Mülheim gelungen, das antiaromatische Fluorenylkation bei extrem tiefen Temperaturen in Wassereis zu fixieren. So konnten sie es erstmals spektroskopisch untersuchen.
Über ihre Ergebnisse berichteten die Wissenschaftler in 'Angewandte Chemie' [siehe Literatur-Hinweis unten].
Grundlegendes Konzept lässt sich nicht untersuchen
Das Konzept der 'Aromatizität' ist von grundlegender Bedeutung für die Chemie und in jedem Lehrbuch und in jeder Einführungsvorlesung der Organischen Chemie zu finden. Als 'aromatisch' werden ungesättigte Ringmoleküle bezeichnet, die erheblich stabiler sind als erwartet. Der Name Aromat bezieht sich auf den Geruch der ersten entdeckten aromatischen Verbindungen und steckt z. B. auch im Markennamen ARAL = Aromaten und Aliphaten. Das theoretische Konzept der 'Aromatizität' wurde dadurch untermauert, dass es auch den umgekehrten Effekt gibt: die 'Antiaromatizität', die zu einer Destabilisierung von Molekülen führt. "Das Problem an diesem Konzept ist, dass Antiaromaten, wie von der Theorie gefordert, sehr instabil sind und sich nicht ohne weiteres herstellen und untersuchen lassen", erklärt Prof. Dr. Wolfram Sander von RESOLV.
Konzeptionell verblüffend einfach
Im Rahmen des Exzellenzclusters haben Sander und Kollegen nun untersucht, wie sich geladene, hoch reaktive Moleküle mit Wasser als Lösungsmittel bei extrem tiefen Temperaturen stabilisieren lassen. Eine experimentelle Arbeitsgruppe der Fakultät für Chemie und Biochemie der RUB konnte zusammen mit einer Theoriegruppe vom MPI für Kohlenforschung in Mülheim das lange gesuchte antiaromatische Fluorenylkation isolieren, ein Prototyp des Konzepts Antiaromatizität. Dazu hüllten sie dieses Molekül bei extrem tiefen Temperaturen von drei Kelvin - nur drei Grad Celsius oberhalb des absoluten Temperaturnullpunkts - in Wasser ein.
"Unter diesen Bedingungen ist dieses Molekül völlig stabil und lässt sich spektroskopisch untersuchen", erläutert Wolfram Sander das Ergebnis. Bei Raumtemperatur dagegen zeigt es seine extreme Instabilität: In nur fünf Picosekunden (fünf billionstel Sekunden) ist es verschwunden. "Das ist eine Zeitspanne, in der selbst das Licht nur 1,5 Millimeter weit kommt", verdeutlicht der Forscher.
"Dies zeigt sehr schön, wie effektiv die konzeptionell verblüffend einfache neue Methode zur Stabilisierung von Molekülen funktioniert."
Zusatzinformationen:
Paolo Costa, Iris Trosien, Miguel Fernandez-Oliva, Dr. Elsa Sanchez-Garcia und Prof. Dr. Wolfram Sander:
The Fluorenyl Cation.
In: Angewandte Chemie; online veröffentlicht am 05. Februar 2015, DOI 10.1002/ange.201411234
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 10.02.2015.
Permalink: https://www.internetchemie.info/news/2015/feb15/stabilisiertes-fluorenyl-kation.php
© 1996 - 2025 Internetchemie ChemLin