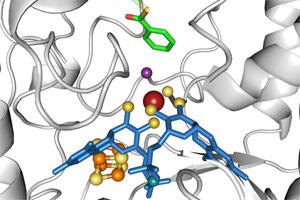
Ein Forschungsteam der Universität Freiburg um Prof. Dr. Matthias Boll und seine Doktorandin Simona G. Huwiler hat herausgefunden, wie Bakterien mithilfe eines Enzyms aromatische Benzolringe - extrem stabile Verbindungen aus sechs Kohlenstoffatomen - ohne Beteiligung von Sauerstoff abbauen können. Die Analyse der Kristallstruktur dieses Schlüsselenzyms ergab, dass ein Wolfram-Atom im katalytischen Zentrum maßgeblich an der Zerstörung des aromatischen Systems des Benzolrings beteiligt ist. Wolfram ist das schwerste Metall mit biologischer Funktion. Da Benzolringe in der Natur häufig vorkommen, ist es für Mensch und Umwelt wichtig zu wissen, wie sie im globalen Kohlenstoffzyklus recycelt werden. Dies gilt insbesondere, weil sich im Erdöl schwer abbaubare, oft toxische und krebserzeugende aromatische Verbindungen anreichern. Das Team veröffentlichte die Ergebnisse in der Fachzeitschrift Nature Chemical Biology [vgl. Literatur-Hinweis unten].
Aromatische Benzolringe werden überwiegend von Holzpflanzen gebildet und zeichnen sich durch einen charakteristischen Geruch aus. Seit langem ist bekannt, dass sauerstoffabhängige Bakterien diese Ringe mit Hilfe von Sauerstoff abbauen. Wie jedoch Bakterien in Bereichen ohne Sauerstoff wie in Sedimenten von Meeren oder Flüssen, kontaminiertem Grundwasser oder Biogasanlagen aromatische Verbindungen abbauen, war bislang unklar. Das Team um Boll hat durch die Aufklärung der Struktur des Enzyms Klasse-II-Benzoyl-CoA-Reduktase entdeckt, wie ein Wolfram-Cofaktor das aromatische System des Benzolrings ohne Beteiligung von Sauerstoff aufbrechen kann. Die Reaktion reduziert das aromatische Ringsystem zu einem nicht-aromatischen zyklischen Dien. Der weitere Abbau dieses Produktes ist dann vergleichsweise einfach.
Eine analoge Reaktion ist seit 70 Jahren bekannt: 1944 beschrieb Arthur Birch die heute als Birch-Reduktion in Lehrbüchern bekannte Synthese von zyklischen Dienen aus aromatischen Ringen. Sie wird unter anderem bei der Synthese von Arzneimitteln eingesetzt, benötigt allerdings giftige Substanzen wie Alkali-Metalle und Ammoniak. Ein Biokatalysator, der ohne diese giftigen Substanzen eine gleichartige Reaktion katalysiert, ist biotechnologisch interessant.
Die Ergebnisse dieser Studie entstanden unter der Leitung von Matthias Boll in Zusammenarbeit mit Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für Biophysik in Frankfurt sowie französischer und kanadischer Forschungseinrichtungen. An der Forschung beteiligt waren auch Dr. Till Biskup und Prof. Dr. Stefan Weber vom Institut für Physikalische Chemie der Universität Freiburg. Matthias Boll leitet eine Arbeitsgruppe am Institut für Biologie II der Universität Freiburg und ist Projektleiter an der Spemann Graduiertenschule für Biologie und Medizin (SGBM) sowie des Graduiertenkollegs GRK 1976 "Funktionelle Diversität von Cofaktoren in Enzymen". Zudem ist er Sprecher des von der Deutschen Forschungsgemeinschaft (DFG) geförderten Schwerpunktprogramms "Biologische Transformationen von Kohlenwasserstoffen ohne Sauerstoff: vom molekularen zum globalen Maßstab" (SPP 1319).
Zusatzinformationen:
Tobias Weinert, Simona G Huwiler, Johannes W Kung, Sina Weidenweber, Petra Hellwig, Hans-Joachim Stärk, Till Biskup, Stefan Weber, Julien J H Cotelesage, Graham N George, Ulrich Ermler, Matthias Boll:
Structural basis of enzymatic benzene ring reduction.
In: Nature Chemical Biology; online erschienen am 29. Juni 2015, DOI 10.1038/nchembio.1849
Quelle: Albert-Ludwigs-Universität Freiburg im Breisgau
Aktualisiert am 10.07.2015.
Permalink: https://www.internetchemie.info/news/2015/jul15/aromatische-ringsystem-spaltende-Enzyme.php
© 1996 - 2026 Internetchemie ChemLin