|
|
|
|
|
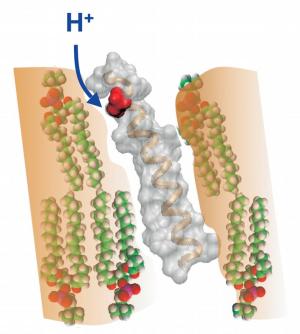
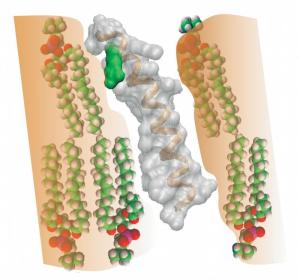
Zahlreiche Rezeptoren sind aus sieben Proteinsegmenten - ein solches Segment ist in den Bildern dargestellt - aufgebaut. Gezeigt ist die Struktur des Protonen-Schalters des Sehfarbstoffes Rhodopsin. Dessen schraubenförmige Grundstruktur liegt auch in dem synthetisch erzeugten Proteinsegment vor, das sich in eine Membran einbetten lässt (orange, mit einzelnen Lipidmolekülen). Am oberen Ende des Segments befindet sich eine negativ geladene Atomgruppe (rot; Bild
oben), die durch Aufnahme eines Protons (H+) neutralisiert wird. Dies ermöglicht das Eintauchen der gesamten chemischen Gruppe (grün) in die elektrisch neutrale Membran (Bild
unten). Diese Strukturänderung stellt einen autonomen Protonen-Schalter dar und trägt im Gesamtmolekül entscheidend zur Rezeptoraktivierung bei.
[Bildquelle: FZD]
|
Biologische Schalter - auch Rezeptoren genannt - sind komplexe Moleküle, die insbesondere in den Zellwänden sitzen. Sie ermöglichen die Reaktion einer Zelle auf äußere Reize, indem sie immer dann Stoffwechselvorgänge an- und abschalten, wenn eine entsprechende chemische Substanz an die Außenseite der Zelle bindet. Obwohl jeder Rezeptor nur auf eine ganz bestimmte Substanz anspricht, besitzen viele von ihnen einen sehr ähnlichen molekularen Aufbau. Das führte die FZD-Wissenschaftler zu der Annahme, dass den Rezeptoren ein einheitlicher Schaltmechanismus zugrunde liegen könnte. Um dies zu untersuchen, beschäftigten sie sich mit einem Rezeptortyp, der aus sieben Molekülbereichen besteht. Im Menschen sind etwa 1.000 solcher siebenteiligen Rezeptoren bekannt, wo sie als Schalter für Hormone, Neurotransmitter, Geruchsstoffe oder auch Licht arbeiten. Mehr als die Hälfte aller verschreibungspflichtigen Medikamente wirken auf Rezeptoren dieses Typs. "Wir haben nachgewiesen, dass ein wichtiger Teil des Schaltvorgangs nicht direkt durch die chemische Struktur von Hormonen oder anderen reizauslösenden Substanzen bewirkt wird", so die FZD-Wissenschaftler Dr. Karim Fahmy und Sineej Madathil. Vielmehr spielt sich ein entscheidender Vorgang in einem Bereich des Rezeptors ab, den die Wissenschaftler "Protonen-Schalter" nennen, weil dafür Protonen, also positiv geladene Wasserstoffatome, eine zentrale Rolle spielen. Sie sind ein natürlicher Bestandteil von Wasser und daher auch im Zellinnern vorhanden. Der Schaltvorgang findet in einem Molekülteil statt, der an das Zellinnere grenzt, während die Erkennung chemischer Reize an der Außenseite des Rezeptors erfolgt. Die Forscher fanden heraus, dass der "Protonen-Schalter" wie in einem arbeitsteiligen Aufbau als eigenständiges Modul funktioniert. "Im Laufe der Evolution musste dieser Schaltmechanismus also nicht für jeden neuen Botenstoff neu erfunden werden. Stattdessen blieb das erfolgreiche Modul im siebenteiligen Gesamtaufbau der Rezeptormoleküle erhalten, während sich die chemischen Erkennungsregionen an die verschiedensten Signale angepasst haben", erklärt Dr. Fahmy. Die äußeren chemischen Signale haben lediglich die Aufgabe, die Stelle des Rezeptors freizulegen, mit der die Protonen reagieren können. Neben der grundlegenden medizinischen Bedeutung der Ergebnisse sehen die FZD-Forscher in dem von ihnen künstlich hergestellten, einfachen Protonen-Schalter ein großes Potenzial für Anwendungen im Bereich der Sensorik. So könnten Minilabore in Form künstlicher Zellen hergestellt werden, die über solche Schaltmechanismen mit ihrer Außenwelt kommunizieren - ein Vorgang, der u.a. in der Umweltanalytik zum Nachweis und der Entfernung von toxischen Substanzen eingesetzt werden könnte.
|