|
|
|
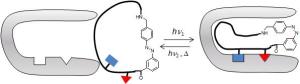
Beim Schalter in gestreckter trans-Form passt das Peptid nicht in die Bindungstasche des Proteins, bei gefalteter cis-Form nimmt das Peptid die Form des Haarnadel-ß-Faltblatts an und kann wechselwirken.
[Grafik: Hoppmann/FMP]
|
|
|
|
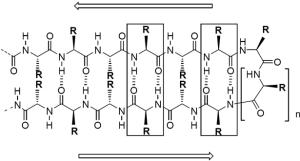
Aminosäuresequenz (Primärstruktur) mit den Aminosäureresten
[Abbildung: Abb.Acc. Chem. Res. 1997, 30, 153-161]
|
|
|
|
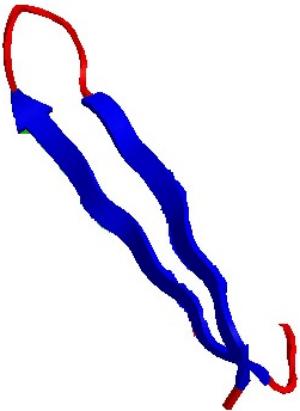
Sekundärstruktur einer ß-Haarnadel
[Abbildung: FVB]
|
Wissenschaftlern vom Leibniz-Institut für Molekulare Pharmakologie (FMP) ist ein entscheidender Schritt in diese Richtung gelungen: Sie haben einen Lichtschalter in ein Peptidmodell eingefügt, das einen Teil eines biologisch aktiven Proteins modelliert. Befindet sich der Schalter im Grundzustand, hindert er das Peptid daran, an das Protein zu binden. Wird der Schalter durch Bestrahlung "umgelegt", lässt er die Bindung des Peptids an sein Zielprotein zu. Christian Hoppmann vom FMP erläutert: "Mit diesem Modellpeptid können wir die entsprechende natürliche Protein-Protein-Wechselwirkung und damit die entsprechende Signalkette mittels Licht steuern." Ein Peptid ist ein kleines Protein, wie dieses besteht es aus Aminosäuren in einer definierten Reihenfolge, die die biologische Information zur Wechselwirkung mit anderen Molekülen wie Proteinen enthält. Ein bekanntes Peptid ist Insulin zur Regulierung des Blutzuckerspiegels, ebenso Gastrin, das die Produktion von Magensäure anregt. Peptide beeinflussen also gezielt Funktionen des Körpers - genau das sollen auch Medikamente tun - und darüber hinaus haben sie als körpereigene Substanzen den Vorteil, kaum Abwehrreaktionen des Körpers hervorzurufen. Peptide können ihre Form verändern, indem sie untereinander Wasserstoffbrückenbindungen ausbilden. Diese sogenannte Sekundärstruktur kann eine Helix, also eine Spirale, oder ein Haarnadel-beta-Faltblatt sein. Gelingt es mit Hilfe eines molekularen Schalters, in einem Peptid, die Sekundärstruktur zu destabilisieren oder zu fördern, lässt sich damit die Peptideigenschaft kontrollieren. Der molekulare Schalter, den die FMP-Wissenschaftler in das Peptid eingebaut haben, liegt im Grundzustand in einer gestreckten Form vor, der sogenannten trans-Form. In dieser gestreckten Form hält der Schalter die beiden Ketten des Peptids auseinander und hindert sie daran, eine Sekundärstruktur zu bilden. Durch Bestrahlung mit UV-Licht der Wellenlänge von ca. 330 Nanometern wird der Schalter in die sogenannte cis-Form überführt, die den beiden flankierenden Peptidketten erlaubt, miteinander Wasserstoffbrückenbindungen und damit eine Sekundärstruktur auszubilden. Mit dem Schalter in der cis-Form wandelt sich das Peptid also in die für die Wechselwirkung mit dem Protein notwendige Haarnadel-ß-Faltblattstruktur um. Das Peptid bindet so an die spezifischen Stellen im Protein. Christian Hoppmann sagt: "Wir haben uns das Prinzip beim Sehprozess abgeguckt. Beim Sehen passiert nämlich auf der Retina genau das Gleiche: Durch Lichteinfall wird in dem natürlichen Schaltersystem ein Übergang von cis- zu trans-Form bewirkt, wodurch eine Strukturänderung in dem beteiligten Protein ausgelöst und das Signal übertragen wird." Im FMP ist es gelungen, das erste wasserlösliche, lichtschaltbare Peptidmodell einer Haarnadel-ß-Faltblattstruktur zu entwickeln, deren biologische Funktion mit Licht gesteuert werden kann. Diese sind in einer Vielzahl biologisch wichtiger Proteinwechselwirkungen involviert.
|