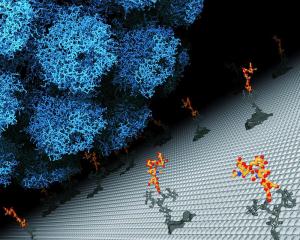
 |
Das menschliche JC Polyomavirus beim Andocken an eine Zelle - der erste Schritt für eine erfolgreiche Infektion. Neue Forschungsergebnisse des Tübinger Biochemikers Prof. Thilo Stehle und seiner Arbeitsgruppe zeigen mit atomarer Genauigkeit, wie das Virus (blau) an ein bestimmtes Zuckermotiv gelb) auf der Zelloberfläche bindet.
[Bildquelle: Ursula Neu, Universität Tübingen] |
„Wir wissen sehr wenig darüber, wie Viren an Zellen binden und was sie danach machen“, sagt der Tübinger Biochemiker Prof. Dr. Thilo Stehle. Im Prinzip ist zwar bekannt, dass die Struktur des Virus und die Eigenschaften der Zelloberfläche zusammenpassen müssen, damit das Virus überhaupt erst einmal an der Zelle andocken kann. Dafür wird gerne das Bild vom Schlüssel verwendet, der in ein Schloss passen muss. In Wirklichkeit, so der Leiter des Interfakultären Instituts für Biochemie (IFIB) der Universität Tübingen, genügt ein einzelner Schlüssel meist nicht. Auf der Virusoberfläche finden sich meist mehrere Stellen, die an Zucker- oder Proteinmoleküle an der Zelloberfläche, die sogenannten Rezeptoren, binden können. Anhand dieser Rezeptoren erkennt das Virus seine Wirtszellen, dockt an diese an und beginnt damit die Infektion.
Stehle und seine Mitarbeiter haben nun in einem internationalen Forschungsverbund an einem konkreten Beispiel den Mechanismus des Andockens mit atomarer Genauigkeit beschrieben. Sie haben die atomare Struktur des Hüllproteins des beim Menschen sehr verbreiteten JC-Virus entschlüsselt, das zur Familie der Polyomaviren gehört, und damit zum ersten Mal überhaupt die atomare Struktur eines den Menschen befallenden Polyomavirus beschrieben.
Das JC-Virus ist ein weit verbreitetes Virus, mit dem schätzungsweise siebzig bis neunzig Prozent der Weltbevölkerung infiziert sind. Allerdings löst es bei der überwiegenden Zahl der Menschen keinerlei Symptome aus, da das Immunsystem die Viren unter Kontrolle hält. Dadurch bleibt die Infektion auf das Nierengewebe beschränkt, und richtet dort keinen Schaden an. Wenn das Immunsystem seine Aufgaben jedoch nicht erfüllt, kann das JC-Virus lebensgefährlich werden. Dies kann bei Patienten mit der Immunschwächekrankheit AIDS der Fall sein, oder auch bei Menschen mit Autoimmunkrankheiten, deren Immunsystem mit Medikamenten unterdrückt werden muss. In solchen Fällen kann das Virus ins Gehirn wandern, wo es die Myelinschichten der Nerven zerstört, ohne die die Nervensignale nicht mehr übertragen werden können. Die Menschen erkranken an progressiver multifokaler Leukenzephalopathie, die bis heute nicht heilbar ist und zum Tode führt. Wegen der klinischen Bedeutung des Virus hat die US-Gesundheitsbehörde NIH die Forschungsarbeit finanziell gefördert.
Das Virus, so das Ergebnis der Studie, dockt auf einer Wirtszelle an einem bestimmten Zuckermolekül an, das mit LSTc (Lactoseries tetrasaccharide c) bezeichnet wird. Im Labor konnten die Wissenschaftler die Bedeutung dieser Erkenntnis demonstrieren: Brachten sie JC-Viren mit LSTc in Kontakt, bevor die Viren Zellen infizieren konnten, dann waren diese Viren nicht mehr infektiös, weil die Andockstellen bereits mit LSTc belegt waren.
Um den Andock-Vorgang auf der molekularen Ebene verstehen zu können, machten es sich die Tübinger Forscher zur Aufgabe, einen Schnappschuss des JC-Virus bei der Bindung an LSTc aufzunehmen, und zwar mit atomarer Genauigkeit. Dazu ließen sie das Hüllprotein des JC-Virus, das sogenannte VP1, kristallisieren und untersuchten es mittels Röntgenstrukturanalyse. Diese aufwendige Methode liefert ein sehr detailliertes Bild der Proteinstruktur. Als dann LSTc in die VP1-Kristalle eingebracht wurde, konnte die Bindung zwischen LSTc und VP1 direkt beobachtet werden. Dabei zeigte die Tübinger Gruppe, dass VP1 das L-förmige LSTc-Molekül an der Form erkennt. Insbesondere definierten die Forscher die Stelle auf VP1, die für das Andocken an LSTc verantwortlich ist. Als sie nämlich Mutationen an dieser Stelle einbrachten, verlor das JC-Virus seine Fähigkeit, Zellen zu infizieren und sich zu vermehren. Damit haben die Forscher einen Angriffspunkt auf dem JC-Virus aufgezeigt, an dem man verhindern kann, dass das Virus an Zellen andockt, was entscheidend dafür ist, dass das Virus eine Zelle infizieren und sich weiter verbreiten kann.
„Unsere Ergebnisse bilden eine leistungsfähige Grundlage für die Entwicklung neuer antiviraler Wirkstoffe“, so die Forscher, „denn sie machen es möglich, die Virusinfektion schon beim allerersten Schritt, bei der Erkennung der Wirtszelle, zu unterbinden.“
Die Ergebnisse der Studie erschienen unter dem Titel „Structure-function analysis of the human JC polyomavirus establishes the LSTc pentasaccharide as a functional receptor motif“ in der Ausgabe vom 21. Oktober 2010 der Fachzeitschrift „Cell Host & Microbe“. An der Arbeit beteiligt sind außer dem IFIB der Universität Tübingen Forscher um Prof. Walter Atwood von der Brown-University, USA, und um Prof. Ten Feizi vom Imperial College London, Großbritannien.
Thilo Stehle beschäftigt sich seit vielen Jahren mit der Frage, ob es Gemeinsamkeiten darin gibt, welche Strukturen Viren erkennen. „Unsere Ergebnisse verstehen wir zum einen als Grundlage für die Erforschung anderer Viren. Zum anderen können wir nun in das Drug Design einsteigen, die Entwicklung eines möglichen Medikaments.“ Denn die Infektion durch das Virus konnte im Labor zwar mit dem Zucker LSTc blockiert werden. Doch Zucker eignen sich nicht gut als Medikamente, da sie relativ schwache Bindungen eingehen. „Ziel ist es, ein Molekül zu entwickeln, das an dieselbe Stelle auf VP1 bindet wie LSTc. Es muss aber viel stärker binden, damit es das Andocken des Virus effektiv verhindern kann“, sagt Stehle.
Die jetzt veröffentlichten Forschungsergebnisse konnten nur in internationaler Kooperation mit Spitzenteams gewonnen werden. Jeder der Kooperationspartner brachte seine besondere Expertise ein. Die Arbeitsgruppe in London verfügt über die weltweit größte Screening-Plattform, mit der Proteine und Viren auf die Erkennung verschiedener Kohlenhydrate getestet werden können. Diese Gruppe identifizierte LSTc als Bindungspartner für das JC-Virus. Die Arbeitsgruppe an der Brown University ist weltweit führend bei der Erforschung der Infektionswege menschlicher Polyomaviren. Dort wurde an infektiösen Viren nachgewiesen, dass LSTc tatsächlich als Rezeptor fungiert. Außerdem zeigte die Gruppe, dass die JC-Viren ihre Infektivität verloren, wenn die Erkennung von LSTc auf Wirtszellen gestört war.
Aufgabe des Interfakultären Instituts für Biochemie der Universität Tübingen war es in dieser Kooperation, die atomare Struktur der Bindung des Virus an LSTc zu analysieren. Eine solche atomare Aufklärung von Virus-Zellinteraktionen wird weltweit nur von wenigen Arbeitsgruppen erfolgreich durchgeführt, und die Arbeitsgruppe Stehle hat hiermit langjährige Erfahrung. Thilo Stehle: „Trotzdem gab es bei diesem Projekt einige Probleme zu überwinden, da der Ligand mit relativ geringer Affinität an das Virus bindet und deshalb die Herstellung des Komplexes und die Visualisierung der Bindung technisch schwierig war.“ Die Proteinkristalle, die im Labor in Tübingen hergestellt werden konnten, waren recht klein. Die Röntgenquelle des Labors reichte daher nicht aus, die Struktur der Kristalle mit zufriedenstellender Genauigkeit abzubilden. Die Streudaten wurden deshalb an einem Hochenergie-Elektronensynchrotron in der Schweiz aufgenommen, der Swiss Light Source in Villigen.