Als Koordinationsgeometrie oder Komplexgeometrie bezeichnet man im allgemeinen die räumliche Konstellation der Atome in einem chemischen Komplex, einem Molekül (Molekülgeometrie), einem Festkörper, einem Kristall etc. Der Fokus wird hierbei auf das Zentraltom gesetzt, das an mehrere Atome - den Liganden - gebunden ist und von diesen umgeben wird. Betrachtet man die räumliche Anordnung dieser Liganden um das zentrale Atom, so erkennt man ein geometrisches Muster, in Abhängigkeit von Anzahl und Typ der beteiligten Atome.
Übersicht über die Koordinations-Geometrien
Nachfolgend sind häufige geometrische Konstellationen einschließlich Abbildungen und Kurzbeschreibungen nach aufsteigender Koordinationzahl aufgeführt. Die Zentralatome sind rot gefärbt, die Liganden grün und die koordinativen Bindungen grau.
Zur Veranschaulichung sind die jeweiligen Polyeder rechts abgebildet. Die schraffierten Flächen dienen der Orientierung, ebenso eventuell angedeutete Elektronenorbitale, die bei der Koordinationsgeometrie nicht berücksichtigt werden; diese können ähnlich wie die Bindungspartner betrachtet werden und werden als Pseudo-Liganten bezeichnet; die Gesamtdarstellung ergibt dann die so genannte Pseudo-Struktur.
Linear
Symbol: D∞h; Koordinationszahl: 2; Koordinationspolyeder: Nein.

Bei der linearen Koordination befinden sich zwei Liganden gemeinsam mit dem Zentralatom auf einer geraden Linie. Der Bindungswinkel beträgt 180°.
Beispiele für Moleküle mit linearer Koordination sind das Kohlendioxid CO2 und Xenondifluorid. Lineare Anionen sind das Azid-Ion N3- und das Thiocyanat-Ion SCN-, ein lineares Kation das Nitronium-Ion NO2+.
Gewinkelte Molekülgeometrie
Symbol: C2v; Koordinationszahl: 2; Koordinationspolyeder: Nein.
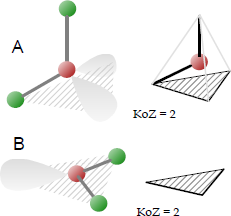
In der Chemie haben Moleküle mit einer nicht kollinearen Anordnung zweier benachbarter Bindungen eine gewinkelte Molekülgeometrie. Bestimmte Atome wie Sauerstoff besitzen aufgrund ihrer Elektronenkonfiguration fast immer zwei (oder mehr) kovalente Bindungen in nicht-lineare Richtungen. Wasser (H2O) ist das bekannteste Beispiel hierfür.
Es gibt verschiedene Varianten der Winkelung, wobei AX2E2 (sterische Zahl = 4; E = freies Elektronenpaar) am häufigsten ist: Zwei kovalente Bindungen und zwei einzelne Elektronenpaare des Zentralatoms bilden eine vollständige 8-Elektronen-Hülle. Der Bindungswinkel am zentralen Atom liegt zwischen 104° und 109,5 °, abhängig von der Art der Liganden.
Beispiele für eine gewinkelte Molekülgeometrie: Wasser H2O, Schwefeldioxid SO2, Stickstoffdioxid NO2, die R-O-H Gruppe; Ozon O3 und NO2 für B (in der Abbildung, Winkel ca. 120 °, sterische Zahl = 3) u. a.
Englisch Bezeichnungen: Angular; bent molecular geometry.
Trigonal-planar
Punktgruppe: D3h; Koordinationszahl: 3; Koordinationspolyeder: Nein.
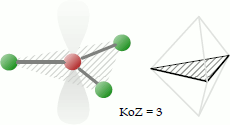
Bei der trigonal-planaren Koordination befinden sich drei Liganden gemeinsam mit dem Zentralatom auf einer dreieckigen Fläche. Der Bindungswinkel beträgt 120°.
Beispiele für Moleküle mit trigonal-planarer Koordination sind das Bortrifluorid BF3, Schwefeltrioxid SO3 etc. Zu den Trigonal-planar koordinierten Ionen zählen u. a. das Nitrat-und das Carbonat-Ion.
Trigonal-pyramidal
Punktgruppe: C3v; Koordinationszahl: 3.
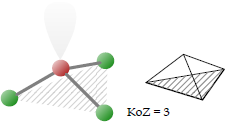
Bei der trigonal-pyramidalen Koordination befinden sich die drei Liganden auf einer dreieckigen Fläche, die die Basis einer gedachten dreiseitigen Pyramide bildet. Das Zentralatom befindet sich an der Spitze der Pyramide; ein freies Elektronenpaar gegebenenfalls darüber. Der Bindungswinkel kann zwischen 90° und 109,5 ° betragen.
Beispiele für Moleküle mit trigonal-pyramidaler Koordination sind die Pnictogenhydride XH3, wie Ammoniak NH3, Phosphin etc. sowie Phosphin u. a. Zu den Trigonal-planar koordinierten Ionen zählen u. a. das Chlorat-Ion.
T-förmig
Punktgruppe: C2v; Koordinationszahl: 3.
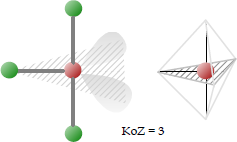
Eine T-förmige Geometrie, wenn drei Liganden und zwei einzelne Elektronenpaare an ein Zentralatom gebunden sind. Diese T-Form hängt mit der trigonal-bipyramidalen Molekülgeometrie für AX5-Moleküle mit drei äquatorialen und zwei axialen Liganden zusammen (siehe unten). Die Bindungswinkel sind 90° und 180 °.
Beispiele für Moleküle mit T-förmiger Koordination sind die Halogentrifluoride wie ClF3.
Englisch Bezeichnung: T-shaped.
Quadratisch-planar
Punktgruppe: D4h; Koordinationszahl: 4; Koordinationspolyeder: Nein.
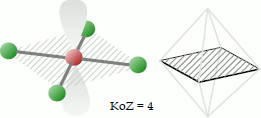
Bei der quadratisch-planaren Koordination befinden sich vier Liganden gemeinsam mit dem Zentralatom auf einer gleichseitig-viereckigen Fläche. Der Bindungswinkel beträgt 90°. Die angedeuteten Orbitale und das Oktaeder dienen der Veranschaulichung der Geometrie bzw. der Pseudo-Struktur.
Beispiele für Moleküle mit quadratisch-planarer Koordination sind das Xenontetrafluorid XeF4, das Tetrachloroplatinat-Anion [PtCl4]2- etc.
Tetraedrisch
Symbol: Td; Koordinationszahl: 4; Koordinationspolyeder: Tetraeder T-4.
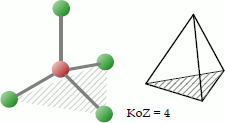
Bei der tetraedrischen Koordination platzieren sich 4 Liganden so um das Zentralatom, dass sie sich an den Ecken eines gedachten Tetraeders befinden. Der Bindungswinkel beträgt bei identischen Liganden 109,5°.
Beispiele für Moleküle mit tetraedrischer Koordination sind das Nickeltetracarbonyl, die organische Verbindung Methan und der Diamant, bei dem jedes Kohlenstoff-Atom von 4 weiteren C-Atomen umgeben ist.
Englisch: tetrahedral.
Trigonal-bipyramidal
Symbol: D3h; Koordinationszahl: 5; Koordinationspolyeder: Dreieckige Bipyramide TBPY-5.
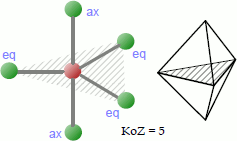
Bei der trigonal-bipyramidalen Koordination platzieren sich 5 Liganden so um das Zentralatom, dass sie sich an den Ecken einer gedachten dreieckigen Doppelpyramide befinden. Die drei in der schraffierten Ebene gelegenen Atome bzw. Atomgruppen werden hier als äquatoriale (eq), die dazu auf einer senkrechten Linie befindlichen, kollinearen Atome als axiale (ax) oder apikale Liganden bezeichnet; der Bindungswinkel beträgt jeweils 120° bzw. 90°.
Beispiele für Moleküle mit trigonal-bipyramidaler Koordination sind das Phosphorpentachlorid PCl5, das Pentachlorstannat-Anion und Eisenpentacarbonyl.
Quadratisch-pyramidal
Punktgruppe: C4v; Koordinationszahl: 5; Koordinationspolyeder: Pyramide mit quadratischer Basis.
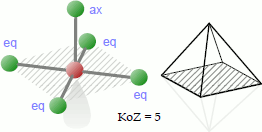
Bei der quadratisch-pyramidalen Koordination platzieren sich 5 Liganden so um das Zentralatom, dass sie sich an den Ecken einer gedachten Pyramide befinden. Die vier in der schraffierten Ebene gelegenen Atome bzw. Atomgruppen werden hier als äquatoriale (eq), das dazu auf einer senkrechten Linie befindliche Atom als axialer (ax) Ligand bezeichnet.
Beispiele für Moleküle mit quadratisch-pyramidaler Koordination sind das Chlorpentafluorid ClF5 und das Pentachloromanganat-Anion [MnCl5]2-.
Oktaedrisch
Symbol: Oh; Koordinationszahl: 6; Koordinationspolyeder: Oktaeder OC-6.
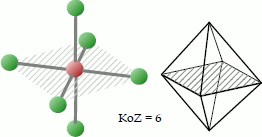
Bei der oktaedrischen Koordination platzieren sich 6 Liganden so um das Zentralatom, dass sie sich an den Ecken eines gedachten Oktaeders befinden. Der Bindungswinkel beträgt bei gleichartigen Liganden 90°.
Beispiele für Moleküle mit tetraedrischer Koordination sind das Hexachloroplatin(IV)-Dianion [PtCl6]2- oder auch die Hexaaquaeisen-Komplexe [Fe(H2O)6]2+ und [Fe(H2O)6]3+.
Englisch: octahedral.
Trigonal-prismatisch
Punktgruppe: D3h; Koordinationszahl: 6; Koordinationspolyeder: Trigonales Prisma.
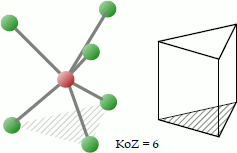
Das trigonale Prisma ist eine bei Koordinationsverbindungen der Koordinationszahl 6 seltener anzutreffendes Koordinationspolyeder. Die 6 Liganden platzieren sich so um das Zentralatom, dass sie sich an den Ecken des gedachten Dreiecksprismas befinden.
Beispiele für Moleküle mit trigonal-prismatischer Koordination sind das neutrale Hexamethylwolfram [W(CH3)6] (analog: Mo, Re), der einfach geladene Hexamethyltantal(V)-Komplex [Ta(CH3)6]- und [Zr(CH3)6]2-.
Englisch: trigonal prismatic.
Quellen und Artikelhinweise
[1] - Coordinatively saturated complex.
Definition im IUPAC Gold Book, DOI 10.1351/goldbook.C01333.
Kategorie: Terminologie
Letzte Änderung am 14. November 2022.
Permalink: https://www.internetchemie.info/chemie-lexikon/k/koordinations-geometrie.php.
© 1996 - 2026 Internetchemie ChemLin