Der Bindungstyp ist damit eine kovalente 2-Zentrums-2-Elektronen- Bindung, bei der die beiden Elektronen vom gleichen Atom stammen und charakteristisches Merkmal der Koordinations-Verbindungen (den Komplexen). Der Elektronennehmer (Akzeptor, der eine entsprechende Elektronen-Lücke aufweist ) wird hier Zentralatom genannt, der oder die Donatoren heissen Liganden.
Diese Art der Wechselwirkung ist unter anderem bei der Lewis-Säure-Base-Theorie von zentraler Bedeutung. In diesem Sinne stellt der Elektronenpaar-Akzeptor eine Lewis-Säure und der Donator die Lewis-Base dar, die über die koordinative Bindung verknüpft sind; das Produkt heisst Lewis-Addukt.
Gegenstand der Synthese, Reaktion und Beschreibung der Eigenschaften koordinativ gebundener Addukte ist die Koordinationschemie (Komplexchemie).
Beispiel Hexacyanidoferrat(II)-Ion:
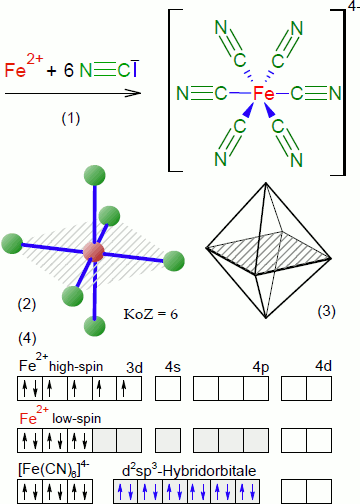
Das Eisen(II)-Kation Fe2+ besitzt sechs 3d-Elektronen, die auf fünf Orbitale zu verteilen sind. Die Elektronenkonfiguration (vgl. Abbildung (4)) für das Ion zeigt eine Verteilung zweier gepaarter sowie 4 ungepaarter Elektronen im d-Orbital - also einen paramagnetischen high-spin-Zustand. Das 4p-Orbital ist beim Fe<sup>2+</sup>-Ion unbesetzt.
Quellen und weitere Informationen:
[1] - A. D. McNaught, A. Wilkinson:
Coordinate Link.
In: Compendium of Chemical Terminology, 2nd ed., the Gold Book, (2014), DOI 10.1351/goldbook.C01329.
Kategorie: Terminologie.
Aktualisiert am 28.02.2019.
Permalink: https://www.internetchemie.info/chemie-lexikon/k/koordinative-bindung.php
© 1996 - 2026 Internetchemie ChemLin