Kohlendioxid trägt zum Treibhauseffekt bei; machbare Lösungen, es einzufangen und zu speichern, sind bisher nicht wirklich gefunden.
Vielleicht ließen sich gleich zwei Fliegen mit einer Klappe schlagen, wenn es gelänge, Kohlendioxid als Rohstoff zu nutzen. Denn anders als die heute üblichen Kohlenstoffquellen Erdöl und Erdgas ist Kohlendioxid ein erneuerbarer Rohstoff und zudem ein umweltfreundliches chemisches Reagens. Leider sind die Kohlenstoff-Sauerstoff-Bindungen aber zu stark, um sie ohne weiteres zu knacken. Bisher wurden dazu meist metallhaltige Katalysatoren verwendet.
In deutsch-kanadischer Kooperation hat Team um Gerhard Erker und Stefan Grimme von der Universität Münster und Douglas W. Stephan von der University of Toronto nun ein neues Konzept entwickelt, das ohne Metalle auskommt: Wie die Forscher der Zeitschrift Angewandte Chemie berichteten [siehe unten], nutzen sie so genannte frustrierte Lewis-Säure/Base-Paare, um Kohlendioxid unter milden Bedingungen reversibel zu binden.
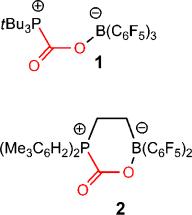
Ein organisches Boran und ein organisches Phosphan bilden ein typischen Lewis-Paar: Das Phosphan als Lewis-Base hat viele Elektronen. Das Boran, die Lewis-Säure, hat dagegen wenige. Also stellt die Lewis-Base der Lewis-Säure ihr freies Elektronenpaar zur Verfügung. Phosphan und Boran bilden dazu ein Addukt, das über dieses nunmehr gemeinsame Elektronenpaar zusammengehalten wird. Wenn beide Partner aber voluminöse Seitengruppen tragen, können die beiden nicht zueinander kommen und die ersehnte Verbindung eingehen. Sie werden dann als Frustriertes Lewis-Paar bezeichnet.
Eine Lösung eines solchen frustrierten Paares bringen die Wissenschaftler unter 2 bar Druck in eine Atmosphäre aus CO2. Sogleich kommt es zu einer Reaktion, bei der ein weißer Feststoff entsteht. Was ist passiert? Das Phosphor-Atom des frustrierten Phosphans bindet mit seinem Elektronenpaar an den Kohlenstoff des CO2, und das Bor-Atom des frustrierten Borans schnappt sich im Gegenzug das freie Elektronenpaar eines der Sauerstoffatome des CO2 und bindet seinerseits daran. Auf diese Weise verkuppelt das Kohlendioxid die beiden Partner miteinander und lindert dabei deren Frustration.
Durch Erwärmen oder durch Zugabe bestimmter Lösungsmittel kann das Kohlendioxid wieder freigesetzt werden, das Lewis-Paar wird in seinen frustrierten Originalzustand zurückversetzt.
Die Forscher untersuchen nun, wie sich das eingefangene CO2 chemisch umsetzen und so als Rohstoffquelle nutzen lässt.
Zusatzinformationen:
Cornelia M. Mömming, Dr. Edwin Otten, Dr. Gerald Kehr, Dr. Roland Fröhlich, Prof. Dr. Stefan Grimme, Prof. Dr. Douglas W. Stephan und Prof. Dr. Gerhard Erker:
Reversible, nicht metallunterstützte Bindung von Kohlendioxid durch frustrierte Lewis-Paare.
In: Angewandte Chemie; online erschienen am 30.06.2009, DOI 10.1002/ange.200901636
Quelle: Angewandte Chemie, Pressemitteilung Nr. 23/200
Aktualisiert am 02.07.2009.
Permalink: https://www.internetchemie.info/news/2009/jul09/frustriertes_lewis-paar_zur_kohlenstoff-fixierung.php
© 1996 - 2026 Internetchemie ChemLin