Das so genannte neuartige Coronavirus SARS-CoV-2 wurde als Erreger der COVID19-Pandemie identifiziert. Die virale Hauptprotease - Mpro oder auch 3CLpro genannt - ist an der Bildung des Coronavirus-Replikationskomplexes beteiligt und stellt ein attraktives Ziel für Wirkstoffe und damit für die Corona-Therapie dar.
Strukturaufklärung
Ihre Kristallstruktur dieser Protease wurde jetzt durch die Forschungsgruppe von Prof. Dr. Rolf Hilgenfeld an der Universität zu Lübeck und im Deutschen Zentrum für Infektionsforschung (DZIF) aufgeklärt. Die Ergebnisse wurden in der naturwissenschaftlichen Fachzeitschrift Science in englischer Sprache veröffentlicht (siehe Verweis unten).
Die Kristallstruktur der Mpro wurde bei einer Auflösung von 1,75 Ångström bestimmt, also in einer Größenordnung von 0,175 Nanometern (nm). Der praktische Nutzen der Strukturaufklärung zeigt sich am Beispiel der Optimierung von niedermolekularen α-Ketoamidinhibitoren. Das Hauptziel der Optimierungsbemühungen war die Verbesserung der pharmakokinetischen Eigenschaften der Substanzen. Auch Kristallstrukturen des Komplexes zwischen dem Enzym und dem stärksten auf diese Weise optimierten α-Ketoamid wurden in hoher Auflösung aufgeklärt (1,95 und 2,20 Å).
Diese Strukturen bilden die Grundlage für die Weiterentwicklung dieser Verbindungen zu antiviralen Arzneimitteln. Die in der genannten Arbeit aufgeklärten viralen Strukturen können auch zur Entdeckung weiterer Wirkstoffe beitragen. Der Weg von der Wirkstoffentdeckung zur Arzneimittelentwicklung erfordert jedoch umfangreiche weitere Studien.
Corona-Hauptprotease
Die Hauptprotease ist ein Schlüsselenzym im Lebenszyklus des Coronavirus, da sie die riesigen Polyproteine prozessiert, in die die virale RNA zunächst übersetzt wird, nachdem es das Innere der menschlichen Zelle erreicht hat. Diese Protease schneidet zwölf kleinere Proteine aus den Polyproteinen heraus, die wiederum Komponenten des Replikationskomplexes bilden, der das Kopieren des viralen RNA-Genoms bewerkstelligt. "Wenn es uns gelingt, die Hauptprotease zu blockieren, können wir daher die Virusreplikation unterbinden", erklärt Prof. Rolf Hilgenfeld.
Der Chemiker und Strukturbiologe hat an solchen Protease-Hemmstoffen seit 2013 gearbeitet, direkt nach Beginn des Ausbruchs des Middle-East Respiratory Syndromes (MERS) auf der arabischen Halbinsel, das durch ein anderes tödliches Coronavirus hervorgerufen wird. Seither entwickelten und optimierten er und sein Team Hemmstoffe, die die Hauptprotease von allen möglichen Coronaviren inhibieren.
"Wir haben sogar sichergestellt, dass unsere Verbindungen auch Fledermaus-Coronaviren blockieren, welche in China entdeckt wurden", sagt Hilgenfeld, der seit 1998 an Coronaviren arbeitet.
Prof. Dr. rer. nat. Dr. h.c. Rolf Hilgenfeld ist Direktor des Instituts für Biochemie der Universität zu Lübeck und arbeitet als Wissenschaftler im DZIF an der Entwicklung von antiviralen Wirkstoffen. Er ist besonders für seine Forschungsergebnisse in der Virologie bekannt geworden.
Während der SARS-Pandemie 2002/03 konnte er die dreidimensionale Struktur der SARS-Virus-Protease und einen ersten Hemmstoff veröffentlichen. Hilgenfeld baute eine enge Partnerschaft mit chinesischen Forschungseinrichtungen auf. 2016 gelang es einem von ihm geleiteten Team, die dreidimensionale Struktur des Spaltungsenzyms des Zikavirus aufzuklären. Damit war die Grundlage für die Entwicklung eines antiviralen Wirkstoffes geschaffen.
Forschung und Ergebnisse
Prof. Hilgenfeld berichtet: Seit dem 11. Januar 2020 arbeiteten wir, meine Mitarbeiterinnen Dr. Linlin Zhang, Xinyuanyuan Sun und ich, fieberhaft an der Aufklärung der dreidimensionalen Struktur eines Schlüsselenzyms des neuen Coronavirus SARS-CoV-2. Am 11. Januar hatte eine chinesische Arbeitsgruppe die Nukleotidsequenz des RNA-Genoms von SARS-CoV-2 veröffentlicht.
Wir identifizierten die Region in dem Genom, die ein virales Schlüsselenzym, die sogenannte Hauptprotease oder 3C-artige Protease, kodiert. Wir übersetzten die entsprechende RNA-Sequenz in DNA, ließen das entsprechende Gen durch eine Firma synthetisieren und exprimierten es in E. coli-Bakterien.
"Ende Januar hatten wir genügend Enzym gereinigt und kristallisiert", sagt Linlin Zhang, "und am 1. Februar transportierten wir diese Kristalle zum BESSY-Synchrotron in Berlin, um sie dort in einen intensiven Röntgenstrahl hineinzubringen. Der Röntgenstrahl wird an dem Kristall in Zehntausende von Röntgenstrahlen geringer Intensität gebeugt; in der Verteilung und der Intensität dieser gebeugten Strahlen steckt Information über die Anordnung aller Atome im dreidimensionalen Raum. "Ein paar Stunden später hatte ich die Struktur durch Anwendung wohletablierter mathematischer Verfahren und ausgereifter Computerprogramme aufgeklärt", sagt Linlin.
Wirkstoff 13b
Anhand der Kristallstruktur der Hauptprotease des neuen Coronavirus konnte Hilgenfeld seine bereits früher entwickelte Leitverbindung in einen potenten Hemmstoff des neuen Coronavirus verwandeln. Die Verbindung wurde unter der Bezeichnung "13b" synthetisiert von Dr. Daizong Lin, einem früheren Postdoc von Prof. Hilgenfeld und jetzigen Forschungsdirektor eines kleinen Unternehmens in Changchun, China.
"Unsere synthetische Arbeit wurde etwas durch das Herunterfahren des öffentlichen Lebens in China verzögert, welches zur Bekämpfung des neuen Coronavirus notwendig war", sagt Daizong. Aber bis Mitte Februar waren größere Mengen des Hemmstoffs vorhanden und konnten an Dr. Katharina Rox, DZIF-Wissenschaftlerin am Helmholtz-Zentrum für Infektionsforschung in Braunschweig, geschickt werden. Sie untersuchte das Verhalten der Verbindung in gesunden Mäusen und zeigte, dass sie nicht toxisch ist und am besten durch Injektion unter die Haut oder durch Inhalation appliziert wird.
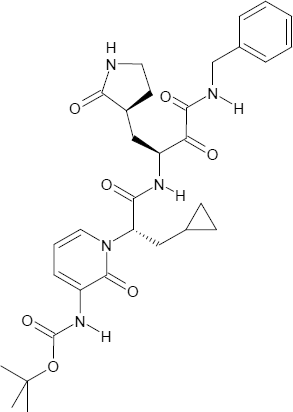
Bei Inhalation sammeln sich ausreichende Konzentrationen von "13b" in der Lunge und in der Niere, also den Organen, welche am stärksten von dem Virus im Menschen befallen werden.
Als nächstes testeten Prof. Stephan Becker und seine Mitarbeiterin Dr. Lucie Sauerhering an der Universität Marburg 13b in Kulturen menschlicher Zungenzellen, die mit dem neuen Coronavirus infiziert waren, und fanden, dass die Verbindung aktiv war. All diese Ergebnisse werden in einer Online-Publikation in dem renommierten Wissenschaftsmagazin "Science" beschrieben (Linlin Zhang et al.).
Die nächsten Schritte
"Jetzt wird unser Wirkstoff zu einem Medikament entwickelt werden müssen", erläutert Rolf Hilgenfeld. "Dafür müssen wir ein pharmazeutisches Unternehmen ins Boot holen, da nur so die finanziellen Belastungen klinischer Versuche getragen werden können". Er erwartet Unterstützung von einem Konsortium von Unternehmen und öffentlichen For-schungsinstitutionen, welches sich gegenwärtig als Teil einer Initiative der Europäischen Kommission zum Kampf gegen das neue Coronavirus bildet.
"Ganz sicher wird es mehrere Jahre dauern, bis unser Wirkstoff zu einem Anti-Coronavirus-Medikament entwickelt sein wird", warnt Hilgenfeld. "Wenn alles gut geht, könnte ein solches Medikament für SARS-CoV-3 zur Verfügung stehen, aber gewiss nicht während des derzeitigen Ausbruchs". Und er fügt hinzu: "In jedem Fall müssen wir die antivirale Forschung von den immer wieder auftretenden Ausbrüchen neu auftretender Viren wie SARS-CoV-2 entkoppeln und sicherstellen, dass wir zu einer nachhaltigen Entwicklung antiviraler Medikamente kommen."
Prof. Hilgenfelds Forschung wird teilweise im Deutschen Zentrum für Infektionsforschung (DZIF) durchgeführt und ab 1. April auch von der Europäischen Kommission unterstützt.
Zusatzinformationen:
Linlin Zhang, Daizong Lin, Xinyuanyuan So, Ute Curth, Christian Drosten, Lucie Sauerhering, Stephan Becker, Katharina Rox und Rolf Hilgenfeld:
Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors.
In: Science; online erschienen am 20. März 2020, open access, DOI 10.1126/science.abb3405
Quelle: Universität zu Lübeck, Pressemitteilung
Aktualisiert am 20.03.2020.
Permalink: https://www.internetchemie.info/news/2020/mar20/struktur_der_hauptprotease_des_coronavirus.php
© 1996 - 2025 Internetchemie ChemLin