|
|
|
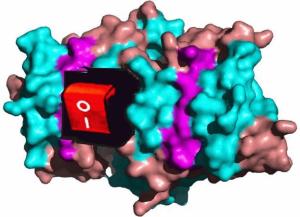
Proteasom in einer Oberflächendarstellung mit einem "integrierten" Schalter
Bildquelle: TU Graz
|
Mit einer guten Nachricht startet die TU Graz ins neue Jahr: Wissenschaftern des Instituts für Biochemie ist es gelungen, den molekularen Mechanismus eines Proteins zu entschlüsseln, das einen Schutz vor der Bildung von Krebszellen im menschlichen Körper darstellen könnte. In ihren Studien zeigten die Forscher, dass nicht alleine der Eiweißstoff Chinonreduktase Prozesse in einer Zelle steuert, sondern dazu insgesamt drei Proteine "kooperieren": Mit Hilfe eines "Kofaktors" ist die Chinonreduktase in der Lage das zelluläre Gleichgewicht zweier Substanzklassen zu registrieren. Ist die Zelle entspannt, bindet sich am "Kofaktor" ein so genannter Transkriptionsfaktor, der als "Wächter des Genoms" wirkt und auf Warteposition gehalten wird. Stressen ungünstige Bedingungen die Zelle, wird der Transkriptionsfaktor freigegeben. Dieser schaltet bestimmte Prozesse, die für den Umgang der Zelle mit Stress und damit für ihr Überleben notwendig sind, an.
Nach dem Vorbild der Bäckerhefe Als Vorbild für die Prozesse im menschlichen Körper diente den Wissenschaftern ein Enzym aus der Bäckerhefe: "Die Ähnlichkeit zu menschlichen Proteinen hilft uns dabei, das System im Menschen besser zu verstehen", erklärt der Projektleiter an der TU Graz, Peter Macheroux, vom Institut für Biochemie der TU Graz. Die Vision der Wissenschafter ist, dass sich der intrazelluläre Protein- "Schalter" im Menschen bewusst betätigen lässt und damit das Risiko für Krebserkrankungen deutlich verringert wird. Dazu ist aber noch Forschungsarbeit von Klinikern und Pharmazeuten notwendig, die auf die erfolgreiche wissenschaftliche Arbeit der Gruppe von der TU Graz aufbaut: "Wir hoffen, mit unseren Erkenntnissen ein besseres Verständnis für das System und damit eine Grundlage für die Entwicklung neuer therapeutischer Möglichkeiten geschaffen zu haben", so Macheroux. Einen wesentlichen Beitrag zum Erfolg der Forschungsarbeiten leistete Jungforscherin Sonja Sollner, die derzeit das Doktoratskolleg (DK) "Molekulare Enzymologie" absolviert. Das DK wird vom Wissenschaftsfonds FWF getragen und ist in die Initiative NAWI Graz - die erfolgreiche Kooperation von Karl-Franzens-Universität und TU Graz in den Naturwissenschaften - eingebettet.
|