Die Nichtmetalle bilden eine Gruppe chemischer Elemente, denen im Gegensatz zu den metallischen Elementen die charakteristischen Eigenschaften eines Metalls fehlen, da die unter anderem schlechte Wärme- und Stromleiter sind, relativ niedrige Dichten, Schmelz- und Siedepunkte aufweisen, hohe Werte für Ionisierungsenergie, Elektronenaffinität und Elektronegativität besitzen, vom Material her nicht-glänzend, gasförmig, unmetallisch spröde bzw. flüssig und nicht formbar sind.
Im Detail zählen alle 17 Nichtmetalle zu den Hauptgruppen-Elementen, namentlich sind es die Edelgase (Helium, Argon, Neon, Krypton, Xenon, Radon - Oganesson ungewiss), die Halogene Fluor, Chlor, Brom, Iod, sowie Sauerstoff, Schwefel, Selen, Stickstoff, Phoshpor, Kohlenstoff und Wasserstoff.
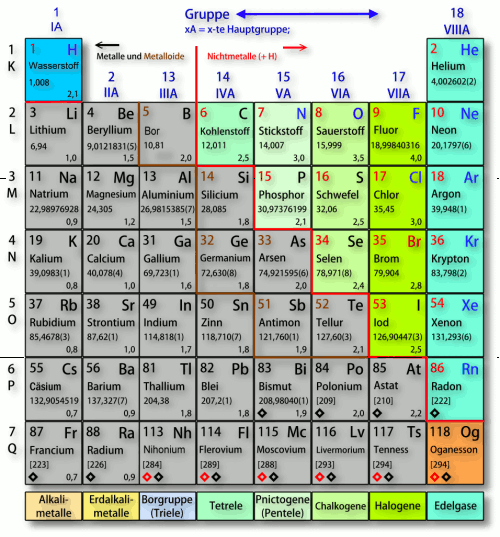
Die Nichtmetalle werden in zwei Kategorien unterteilt, die ihre - unter 'normalen' Bedingungen - relative Neigung zur Bildung chemischer Verbindungen widerspiegeln: nämlich reaktive Nichtmetalle und Edelgase. Die reaktiven Nichtmetalle variieren in ihrem nichtmetallischen Charakter. Die weniger elektronegativen Substanzen, wie Kohlenstoff und Schwefel, haben meist schwache bis mäßig starke nichtmetallische Eigenschaften und neigen dazu, mit Metallen kovalente Verbindungen zu bilden. Die elektronegativeren reaktiven Nichtmetalle wie Sauerstoff und die Halogene zeichnen sich durch stärkere nichtmetallische Eigenschaften und eine Tendenz aus, vorwiegend ionische Verbindungen mit Metallen zu bilden. Die Edelgase hingegen zeigen eine große Abneigung mit anderen Elementen Bindungen einzugehen bzw. Edelgas-Verbindungen zu bilden.
Die Zuordnung eines Elements in die Gruppe der Nichtmetalle oder in eine Untergruppe ist jedoch nicht als absolut zu betrachten. Insbesondere existieren unter bestimmten Bedingungen Modifikationen eines der genannten Elemente, die mehr oder weniger metallische Eigenschaften zeigen. Beispiele sind der Kohlenstoff - in Form des nichtmetallischen Diamants und des Halbmetalls Graphits - oder Wasserstoff in seiner metallartigen Hochdruck-Modifikation.
Zudem gibt es keine allgemein anerkannte Definition eines Nichtmetalls: Elemente auf Plätzen im Periodensystem, in denen die Metalle auf die Nichtmetalle treffen, werden von verschiedenen Lehrbuch-Autoren inkonsistent klassifiziert. Elemente, die manchmal auch als Nichtmetalle klassifiziert werden, sind die Metalloide Bor, Silicium, Germanium, Arsen, Antimon, Tellur und Astat. Das Nichtmetall-Selen wird manchmal als Metalloid eingestuft, insbesondere in der Umweltchemie.
Eigenschaften der Nichtmetalle
Nichtmetalle zeigen untereinander eine größere Vielfalt in ihren Eigenschaften als die Metalle. Diese Eigenschaften werden weitgehend durch die interatomaren Bindungsstärken und molekularen Strukturen bestimmt, die beide variieren, da die Anzahl der Valenzelektronen in jedem Nichtmetall variiert. Im Gegensatz dazu haben Metalle eine homogenere Strukturen und ihre Eigenschaften lassen sich leichter miteinander in Einklang bringen.
Physikalisch existieren die Nichtmetalle unter Normalbedingungen größtenteils als zwei- oder einatomige Gase, wobei der Rest - im Gegensatz zu den Metallen, deren Atome fast alle fest und dicht gepackt sind - eine offen gepackte Atomanordnung aufweist. Die Feststoffe haben - mit Ausnahme von Schwefel - ein submetallisches Aussehen und sind im Gegensatz zu den Metallen, die glänzend und im Allgemeinen duktil oder formbar sind, meist spröde. Dazu haben sie haben normalerweise geringere Dichten, sind schlechtere Leiter für Wärme und Strom und neigen dazu, wesentlich niedrigere Schmelzpunkte und Siedepunkte als die von Metallen aufzuweisen.
Chemisch besitzen die Nichtmetalle meist hohe Ionisierungsenergien, hohe Elektronenaffinitäten (Stickstoff und die Edelgase negative Elektronenaffinitäten) und hohe Elektronegativitäswerte. und im Allgemeinen bilden sie mit Metallen ionische oder kovalente Verbindungen und haben saure Oxide, während die üblichen Oxide fast aller Metalle basisch sind.
Kategorie: Chemische Elemente.
Aktualisiert am 06.05.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/nichtmetalle.php
© 1996 - 2026 Internetchemie ChemLin