Als Edelgase oder Inertgase werden die chemischen Elemente der 18. Gruppe (Helium-Gruppe) bzw. der 8. Hauptgruppe im Periodensystem bezeichnet; diese Grundstoffe sind edel in Hinsicht auf ihre chemische Reaktionsträgheit, also Ihrem Widerstreben, chemische Verbindungen einzugehen, und unter Normalbedingungen - bezogen auf Temperatur und Druck - gasförmig, geruchlos, farblos und nicht brennbar. Im einzelnen sind es die 6 Elemente Helium, Neon, Argon, Krypton, Xenon und Radon; ob sich das Superschwere Element Oganesson auch wie ein Edelgas verhält ist derzeit noch unklar:
Allgemeine Daten
| Helium | Neon | Argon | Krypton | Xenon | Radon | Oganesson | |
|---|---|---|---|---|---|---|---|
| Chemisches Zeichen | He | Ne | Ar | Kr | Xe | Rn | Og |
| Ordnungszahl | 2 | 10 | 18 | 36 | 45 | 86 | 118 |
| Atommasse in u | 4,002602(2) | 20,1797(6) | 39,88 | 83,798(2) | 131,293(6) | [222] | [294] |
| Entdeckung | 1868 | 1898 | 1894 | 1898 | 1898 | 1899 | 2006 |
| CAS-Nummer | 7440-59-7 | 7440-01-9 | 7440-37-1 | 7439-90-9 | 7440-63-3 | 10043-92-2 | 54144-19-3 |
Der edle Charakter dieser inerten Gase sowie viele ihrer chemischen und physikalischen Eigenschaften liegen in der Atomstruktur - insbesondere in der Elektronenhülle - begründet; betrachtet man die Elektronenkonfigurationen der einzelnen Mitglieder, dann erkennt man folgendes Muster: Alle Atomorbitale sind mit der höchst möglichen Anzahl an Elektronen besetzt; keines der Orbital ist unbesetzt.
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 6f | 7s | 7p | Kurzform | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| He | 2 | 1s2 | |||||||||||||||||||
| Ne | 2 | 2 | 6 | [He] 2s2 2p6 | |||||||||||||||||
| Ar | 2 | 2 | 6 | 2 | 6 | [Ne] 3s2 3p6 | |||||||||||||||
| Kr | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | [Ar] 3d10 4s2 4p6 | ||||||||||||
| Xe | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | [Kr] 4d10 5s2 5p6 | |||||||||
| Rn | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 2 | 6 | [Xe] 4f14 5d10 6s2 6p6 | |||||
| Og | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 2 | 6 | [Rn] 5f14 6d10 7s2 7p6 |
Die vollständig besetzten Atomorbitale - die so genannte Edelgaskonfiguration - befinden sich in einem energetisch günstigen Zustand; jede Abgabe oder auch Aufnahme eines Elektrons würde diese Energiebilanz negativ beeinflussen. Daher zeigen die Edelgase unter normalen Reaktionsbedingungen praktisch keinerlei Tendenz, anderen Elementen Elektronen für chemische Bindungen bereitzustellen und Edelgas-Verbindungen zu bilden. Gleichzeitig liegen die Edelgase einatomig vor.
Als erste Edelgas-Verbindung überhaupt wurde 1962 das Xenonhexafluoroplatinat(IV) XePtF6 synthetisiert. Die Substanz ist äußerst instabil und nur bei sehr tiefen Temperaturen isolierbar. Als stabilste Edelgas-Verbindung gilt das Xenonhexafluorid XeF6, das zum Beispiel durch längeres Erhitzen von Xenon mit Fluor in einem Überschuss von 1 zu 20 bei 300 °C und einem Druck von 200 - 300 bar dargestellt werden kann.
Tabelle: Eigenschaften der Edelgase
Daten und Eigenschaften der Edelgase unter normalem Druck (1013 hPa). Daten für Oganesson sind nicht aufgeführt, weil sie bisher noch nicht bestimmt werden konnten.
| Eigenschaft | He | Ne | Ar | Kr | Xe | Rn |
|---|---|---|---|---|---|---|
| Schmelzpunkt [°C] | - | -248,59 | -189,34 | -157,37 | -111,75 | -71 |
| Siedepunkt [°C] | -268,928 | -246,046 | -185,848 | -153,415 | -108,099 | -61,7 |
| Dichte, Gas, 0°C [kg m3] | 0,1752 | 0,9000 | 1,7839 | 3,7493 | 5,8971 | 9,73 |
| Verdampfungswärme [kJ mol-1] | 0,08 | 1,74 | 6,52 | 9,05 | 12,65 | 18,1 |
| Löslichkeit in Wasser bei 20 °C [cm3 kg-1] | 8,61 | 10,5 | 33,6 | 59,4 | 108,1 | 230 |
| Kristallstruktur | hcp | fcc | fcc | fcc | fcc | fcc |
| Gitterparameter [pm] | a = 353,1 c = 569,3 | a = 443 | a = 526 | a = 572 | a = 620 | a = 655 |
Ionisierungsenergien der Edelgase
Die nachfolgende Tabelle führt die Ionisierungsenergie - auch Ionisationsenergie, Ionisierungspotential oder Ionisierungsenthalpie genannt - der einzelnen Edelgas-Atome in Elektronenvolt pro Atom (eV/Atom) sowie in Kilojoule pro Mol (kJ mol-1) auf; es gilt: 1 eV/Atom = (96,485 333 ± 0,000 002) kJ/mol. Die Ionisierungsenergie Ei ist hier als die erforderliche Energie definiert, um das genannte Elektron endgültig von einem Edelgas-Atom zu trennen und dieses zu ionisieren.
| X. IE | He | Ne | Ar | Kr | Xe | Rn |
|---|---|---|---|---|---|---|
| 1. Ei in eV 1. Ei in kJ/mol | 24,587387 2372,322222 | 21,56454 2080,66182 | 15,759610 1520,571219 | 13,99961 1350,757033 | 12,12984 1170,35165 | 10,7485 1037,0726 |
| 2. Ei in eV 2. Ei in kJ/mol | 54,417760 5250,515695 | 40,96296 3952,32484 | 27,62966 2665,85695 | 24,35984 2350,36727 | 20,9750 2023,7799 | |
| 3. Ei in eV 3. Ei in kJ/mol | 63,45 6121,99 | 40,74 3930,81 | 36,950 3565,133 | 32,1230 3099,3984 |
Die Linienspektren der Edelgase
Spektrallinien der Edelgase im sichtbaren Frequenz-Bereich zwischen 400 und 700 Nanometern (nm).
Helium-Spektrallinien

Neon-Spektrallinien

Argon-Spektrallinien

Krypton-Spektrallinien

Xenon-Spektrallinien
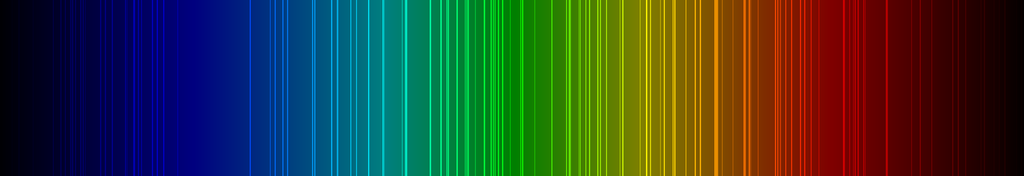
Radon-Spektrallinien

Kategorie: Chemische Elemente
Letzte Änderung am 06. Mai 2020.
Permalink: https://www.internetchemie.info/chemische-elemente/edelgase.php.
© 1996 - 2026 Internetchemie ChemLin