
Xenon - chemisches Symbol Xe, Ordnungszahl 54 - ist ein farbloses, geruchloses, geschmackloses, einatomiges, ungiftiges und sehr reaktiosträges chemisches Element aus der Gruppe der Edelgase.
Übersicht: Allgemeine Daten zum Xenon
Das Xenon-Atom
Das Xe-Atom - und damit das chemische Element Xenon - ist eindeutig durch die 54 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Xenon-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Xenon-Isotope bzw. Xenon-Nuklide zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Xenon-Vorkommen bestehen aus mehreren Isotopen; das Standard-Atomgewicht wird mit 131,293(6) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f |
| Xe | 54 | [Kr] 4d10 5s2 5p6 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Xenon-Atom zu trennen.
| 1. IE: | 12,12984 eV | 2. IE: | 20,9750 eV | 3. IE: | 32,1230 eV | 4. IE: | eV | 5. IE: | eV | 6. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Xenon-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 34561 | 5453 | 5107 | 4786 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 1148,7 | 1002,1 | 940,6 | 689,0 | 676,4 |
| NI | NII | NIII | NIV | NV | NVI | NVII |
| 4s | 4p1/2 | 4p3/2 | 4d3/2 | 4d5/2 | 4f5/2 | 4f7/2 |
| 213,2 | 146,7 | 145,5 | 69,5 | 67,5 | - | - |
| OI | OII | OIII | OIV | OV |
| 5s | 5p1/2 | 5p3/2 | 5d3/2 | 5d5/2 |
| 23,3 | 13,4 | 12,1 |
Weitere Daten
131 pm (in Einfach-Bindungen, nach Pyykkö et al.)
135 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
122 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Ionenradius
Ionenradius des Xe(VIII)-Kations in pm:
| Ion | KoZ | Ieffektiv | Ikristall | Anmerkungen |
|---|---|---|---|---|
| Xe8+ | 6 | 48 | 62 |
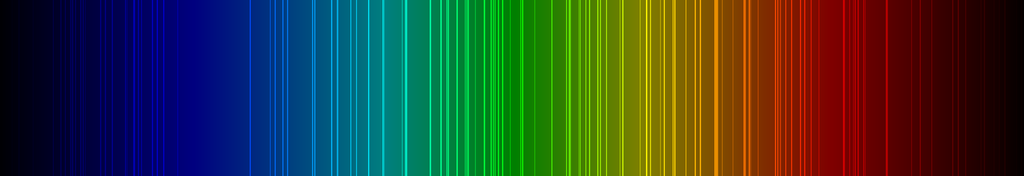
Spektrallinien des Xenons
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Xenons mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemische Daten
2,63 nach Sanderson
5,8121 eV nach Gosh-Gupta
Standardpotentiale
Normalpotential des Xenons:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| 0,99 | + VIII | Perxenat-Anion | [XeO6]4- + 5 H+ | + 2 e- | ⇔ | HXeO4]2- + 2 H2O | Xenat-Anion | + VI |
| 1,18 | + VIII | Hydrogenperxenat-Anion | [HXeO6]3- + 5 H2O | + 8 e- | ⇔ | Xe (g) + 11 OH- | Xenon | 0 |
| 1,24 | + VI | Xenat-Anion | [HXeO4]- + 3 H2O | + 6 e- | ⇔ | Xe (g) + 7 OH- | Xenon | 0 |
| 2,12 | + VI | Xenon(VI)-oxid | XeO3 (aq) + 6 H+ | + 6 e- | ⇔ | Xe (g) + 3 H2O | Xenon | 0 |
| 2,18 | + VIII | Perxenonsäure | H4XeO6 (aq) + 8 H+ | + 8 e- | ⇔ | Xe (g) + 6 H2O | Xenon | 0 |
| 2,32 | + II | Xenondifluorid | XeF2 (aq) + 2 H+ | + 2 e- | ⇔ | Xe (g) + 2 HF (aq) | Xenon | 0 |
| 2,42 | + VIII | Perxenonsäure | H4XeO6 (aq) + 2 H+ | + 2 e- | ⇔ | XeO3 (aq) + 3 H2O | Xenon(VI)-oxid | + VI |
Externe Informationsangebote
Gruppenelemente - Informationen
Die Edelgase
Vorlesungsskript: Die Elemente der Gruppe 18. TU Braunschweig - Format: PDF
Edelgas Gewinnung 1
Schema: Luftzerlegung, Edelgase. Vorlesungmaterialien Technische Anorganische Chemie. Universität Freiburg - Format: PDF
Edelgas Gewinnung 2
Schema: Luftzerlegung, Edelgase, Füllkörperkolonnen, Bödenbauarten. Universität Freiburg - Format: PDF
Edelgase
Tabellarischer Vergleich. Universität Freiburg
Edelgase
Tabellarischer Vergleich. Rutherford
Edelgasverbindungen
Eine Einführung. ETH Zürich, Schweiz - Format: PDF
Edelgasverbindungen
Grundlagen: Chemie der Nichtmetalle. Universität Freiburg
Kategorie: Chemische Elemente
Aktualisiert am 15.05.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/xenon.php
© 1996 - 2025 Internetchemie ChemLin