Das Halbmetall Silicium, chemisches Symbol Si - abgeleitet aus dem Lateinischen: silex = Kiesel - ist ein chemisches Element der Gruppe der Tetrele (4. Hauptgruppe), Ordnungszahl 14.
Übersicht: Allgemeine Daten zum Silicium
Das Silicium-Atom
Das Si-Atom - und damit das chemische Element Silicium - ist eindeutig durch die 14 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Silicium-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Silicium-Isotope bzw. Silicium-Nuklide zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Silicium-Vorkommen bestehen aus einem Isotopengemisch drei verschiedener Nuklide; die relative Atommasse wird mit 28,085 u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d |
| Si | 14 | [Ne] 3s2 3p2 | 2 | 2 | 6 | 2 | 2 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Siliciums auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Si-Atom zu trennen.
| 1. IE: | 8,15168 eV | 2. IE: | 16,34584 eV | 3. IE: | 33,49327 eV | 4. IE: | 45,14215 eV | 5. IE: | 166,769 eV | 6. IE: | 205,27 eV |
| 7. IE: | 246,5 eV | 8. IE: | 303,54 eV | 9. IE: | 351,12 eV | 10. IE: | 401,37 eV | 11. IE: | 476,36 eV | 12. IE: | 523,42 eV |
| 13. IE: | 2437,63 eV | 14. IE: | 2673,182 eV | 15. IE: | eV | 16. IE: | eV | 17. IE: | eV | 18. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Silicium-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 1839 | 149,7 | 99,82 | 99,42 |
Weitere Daten
110 pm (empirisch, nach Slater)
116 pm (in Einfach-Bindungen, nach Pyykkö et al.)
107 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
102 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Spektrallinien des Siliciums
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Siliciums mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:

Chemische Daten
1,74 nach Allred-Rochow
1,916 nach Allen
2,0 nach Mulliken
1,74 nach Sanderson
5,5236 eV nach Gosh-Gupta
4,77 eV nach Pearson
Standardpotentiale
Normalpotential des Siliciums:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -0,14 | 0 | Silicium | Si(s) + 4 H+ | + 4 e- | ⇔ | SiH4 (g) | Monosilan | - IV |
Material- und physikalische Eigenschaften des Siliciums
Die nachfolgende Tabelle führt einige physikalische Daten sowie Materialeigenschaften des reinen elementaren Siliciums auf.
0,705 J g-1 K-1 (spezifisch)
2,57 g cm-3 (flüssig, am Schmelzpunkt)
450,0 kJ mol-1 (gasförmig)
168,0 J mol-1 K-1 (gasförmig)
Externe Informationsangebote
Didaktik und Lehrmaterialien
Didaktische Silicon - Dokumentation
Uni Wuppertal
Gruppenelemente - Informationen
Elementstrukturen der IV. Hauptgruppe
Vortragsskript, Uni Bayreuth
Strukturchemie: Elemente der IV. Hauptgruppe (Tetrele)
Vorlesungsmaterialien, Uni Freiburg
Tetrele (4. Hauptgruppe, Kohlenstoff-Gruppe: Si, Ge, Sn, Pb)
Vorlesungsmaterialien, Uni Freiburg
Verbindungsklassen
Kielselsäuren und Silicate 1
Vorlesungsmaterialien: Anorganische Chemie. ETH Zürich, Schweiz - Format: PDF
Kielselsäuren und Silicate 2
Vorlesungsmaterialien: Anorganische Chemie. ETH Zürich, Schweiz - Format: PDF
Quarz, Quarzgitter
Grundlagen, Uni Bielefeld
Silicatchemie
Umfangreiches Vorlesungsskript
Silicatstrukturen in der Natur
Vortragsskript
Siliciumdioxid und Silicate
Eine Kurzeinführung in die Strukturprinzipien
Siliciumorganische Verbindungen
Von der gezielten Synthese stereochemisch reiner Silane zur selektiven Spaltung der Si-O-Si-Einheit in Disiloxanen. Dissertation Chemie, (2009). TU Dortmund - Format: PDF
Einzelne Verbindungen
Silicium und Siliciumverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Spektroskopische Daten, Spektren
Silicium-NMR-Spektren - 29Si
Grundlagen, Interpretation. VS-C (D) [d]
Geochemie und Biogeochemie
Herstellung von Silicium
Übersichtartikel, Euroquarz
Silicium Mineralien
Informationen und weitere Quellen. Mineralienatlas
Dissertationen
Beiträge zur Chemie des höherkoordinierten Siliciums
Synthese, Struktur und Eigenschaften neuer Silicate mit SiO 3 C 2 -, SiO 4 C -, SiO 5 - und SiO 6 -Gerüst, Beiträge zur Chemie des tetrakoordinierten Siliciiums: Synthese, Struktur und Eigenschaften von Silanen, Silanolen und Siloxanen. Dissertation, 2002. Universität Würzburg
Beiträge zur Chemie des höherkoordinierten Siliciums und Germaniums
Synthese, Struktur und Eigenschaften dianionischer lambda-6-Si-Silicate und lambda-6-Ge-Germanate sowie neutraler penta- und hexakoordinierter Silicium-Verbindungen. Dissertation, 2005. Universität Würzburg
Neuartige silicium-haltige allosterische Modulatoren
... als hochpotente, atypische Förderer der Gleichgewichtsbindung eines orthosterischen Liganden an muskarinischen M2-Acetylcholin-Rezeproren. Dissertation 2002. Universität Bonn
Orts- und zeitaufgelöste optische Spektroskopie an Silizium-Nanokristallen
Dissertation, TU Chemnitz
Pentakooridiniertes und hexakoordiniertes Silicium
Beiträge zur Chemie des penta- und hexakoordinierten Siliciums. Dissertation, 2003. Universität Würzburg
Polyolato-Komplexe des Siliciums in Festkörper und Lösung
Modellverbindungen für die Mobilisierung von Silicium in Organismen. Dissertation, 2003. Universität München
Schwarzes Silicium
Synthese, Charakterisierung und Reaktivität von amorphem, schwarzem Silicium. Dissertation, 2007. Universität Frankfurt
Silicium(IV)-Komplexe
Beiträge zur Chemie des höherkoordinierten Siliciums: Synthese, Struktur und Eigenschaften neuer penta- und hexakoordinierter Silicium(IV)-Komplexe. Dissertation Chemie, (2014). Uni Würzburg
Silicium-Chalcogen-Chemie
Beiträge zur Silicium-Chalcogen-Chemie einschließlich analoger Germanium-, Zinn- und Bleiverbindungen. Dissertation, 2003. TU Freiberg
Silizium- und Kohlenstoffcluster
Struktur und Dynamik. Dissertation, 2001. Universität Konstanz
Struktur und Dynamik mesomorpher, n-alkylsubstituierter Polysilane und Polysilylenmethylene
Dissertation, Uni Freiburg - Format: PDF
Newsarchiv
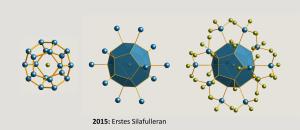
Käfigmolekül aus Silicium 30 Jahre nach der C60-Entdeckung hergestellt.
Neue Chemie mit gelöstem Silizium
Anwendungen in der Herstellung von Silizium-Materialien denkbar ...
Ordnungshilfe für Silicium
Stuttgarter Materialwissenschafter beherrschen die Kristallisationstemperatur von Silicium. Artikel, April 2008
Institute und Forschungseinrichtungen
Arbeitsgruppe Silicium-Chemie
... und chemische Materialwissenschaft. TU Freiberg
Kategorie: Chemische Elemente
Aktualisiert am 24.04.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/silicium.php
© 1996 - 2026 Internetchemie ChemLin