Trichlorfluormethan ist eine chemische Verbindung aus der Gruppe der Chlorfluorkohlenstoffe.
Bezeichnungen und Identifikatoren
Trichlorfluormethan
CCl3F
CFCl3
137,359 (g/mol)
75-69-4
200-892-3
CYRMSUTZVYGINF-UHFFFAOYSA-N
Systematischer Name
Trichloro(fluoro)methan
Weitere Bezeichnungen, Synonyme
Trichlorfluorkohlenstoff; Trichlormonofluormethan; Fluortrichlormethan
Englische Bezeichnung
Trichlorofluoromethane
Fluorochloroform; Fluorotrichloromethane; Trichloro-fluoro-methane
Trichloro(fluoro)methane
Handelsnamen; Präparate
Freon 11; F11; R-11; CFC-11; Arcton 9; Freon HE; Freon MF; Eskimon 11; Daiflon 11; Genetron 11; FCKW-11
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Trichlorfluormethan:
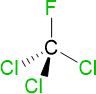
CCl3F oder CFCl3
Mr = 137,3594 g/mol
Trichloro(fluoro)methan
SMILES: C(F)(Cl)(Cl)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Trichlorfluormethan. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Trichlorfluormethan ist eine stabile, nicht brennbare, wasserunlösliche, farblose, in geringen Konzentrationen geruchlose, ansonsten schwach etherartig und süßlich riechende, flüssige Substanz, die bei Raumtemperatur zwischen 23 und 24 °C siedet und in den gasförmigen Zustand übergeht.
+ Löslich in Alkohol, Ether, organischen Lösungsmitteln.
- Praktisch unlöslich in Wasser (1,1 g/L bei 20 °C).
- Verteilungskoeffizient logP = 2,53.
-110,48 °C
23,77 °C
1,479 g cm-3 bei 18 °C
89 kPa bei 20 °C
131 kPa bei 30 °C
18 dyn/cm bei 18°C
nD = 1,3865 bei 18,5 °C
0,45 D
Spektroskopische Daten:
splash10-0udi-3900000000-60273cc56dd64fe65e4d
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Trichlorfluormethan - CCl3F - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 8,65153 %
13C: 0,09269 %
14C: Spuren
Chlor
ΣAr = 106,35 u
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 58,68786 %
36Cl: Spuren
37Cl: 18,73676 %
Fluor
19F: 18,9984 u [100 %]
19F: 13,83116 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 137,359403163 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 7,28 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,007 mol.
Monoisotopische Masse: 135,904961263 Da - bezogen auf 12C35Cl319F.
Synthese, Gewinnung
Das wichtigste kommerzielle Verfahren zur Herstellung von Trichlorfluormethan ist der Ersatz von einem Chlor-Atom in Tetrachlorkohlenstoff durch ein Fluor-Atom unter Verwendung von Fluorwasserstoff (Halogenaustausch). Das traditionelle Flüssigphasenverfahren verwendet Antimonpentafluorid oder eine Mischung aus Antimontrifluorid und Chlor als Katalysatoren; als Nebenprodukt entsteht unter anderem Dichlordifluormethan. Die Ausgangssubstanz CCl4 ist im Rohprodukt ebenfalls enthalten.
Kontinuierliche Dampfphasenverfahren, bei denen gasförmiger Fluorwasserstoff in Gegenwart heterogener Chrom- , Eisen- oder fluorierter Aluminiumoxidkatalysatoren eingesetzt wird, sind ebenfalls weit verbreitet. Das Ausmaß des Chloraustauschs kann durch Variation der HF-Konzentration, der Kontaktzeit oder der Reaktionstemperatur gesteuert werden.
Verwendung
Trichlorfluormethan war bis in die 1990er Jahre das erste weit verbreitete Kältemittel. Aufgrund seines hohen Siedepunkts (im Vergleich zu den meisten Kältemitteln) kann es in Systemen mit niedrigem Betriebsdruck verwendet werden, wodurch die mechanische Konstruktion solcher Systeme weniger anspruchsvoll ist, als die der Hochdruckkältemittel R-12 oder R-22. Weiterhin wurde die Chemikalie als Treibmittel für Polyurethan-Schaum (Bauindustrie) eingesetzt. Als Umweltchemikalie wird ihr ein Ozonabbaupotential von 1,0 zugewiesen.
Die Produktion und die Emissionen von Ozon abbauenden Substanzen wie Trichlorfluormethan (CFC-11) sind seit Mitte der 1980er Jahre als Reaktion auf das Montrealer Protokoll stetig zurückgegangen - allerdings mit einem Anstieg zwischen 2013 und 2017, wobei ein Großteil der ungemeldeten Freisetzung Ostchina zugerechnet wird [vgl. Sunyoung Park et al. 2021].
Weitere Anwendungsgebiete (meist heute nicht mehr gebräuchlich): 19F-NMR-Spektroskopie; Lösungsmittel; Kältemittel, Treibmittel in Feuerlöschern und anderen Aerosolen, elektrische Isolation, Löschen von elektrischen Lichtbögen, dielektrische Flüssigkeit in Blasenkammern und in Windkanälen, Lösungsmittel bei Sulfonierungsreaktionen, chemische Reinigung etc.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H312
Gesundheitsschädlich bei Hautkontakt. - H420
Schädigt die öffentliche Gesundheit und die Umwelt durch Ozonabbau in der äußeren Atmosphäre.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.812 sowie Informationen zu REACh unter ECHA Chem 100.000.812.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Trichlorfluormethan sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 030930.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 138.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 0047 [englisch].
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1956.
Externe Informationsquellen
Hersteller und Bezugsquellen
Trichlorfluormethan als kommerzielles Produkt von international tätigen Lieferanten und Suche nach Analoga siehe unter: ZINC000008214698.
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Trichlorfluormethan als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Trichlorofluoromethane.
[1] - Martin K. Vollmer, Jens Mühle, Stephan Henne et al.:
Unexpected nascent atmospheric emissions of three ozone-depleting hydrochlorofluorocarbons.
In: Proceedings of the National Academy of Sciences, (2021), DOI 10.1073/pnas.2010914118.
[2] - Sunyoung Park, Luke M. Western, Takuya Saito et al.:
A decline in emissions of CFC-11 and related chemicals from eastern China.
In: Nature, (2021), DOI 10.1038/s41586-021-03277-w.
[3] - Stephen A. Montzka, Geoffrey S. Dutton, Robert W. Portmann et al.:
A decline in global CFC-11 emissions during 2018−2019.
In: Nature, (2021), DOI 10.1038/s41586-021-03260-5.
Letzte Änderung am 20.10.2024.
Permalink: https://www.internetchemie.info/substanz/Trichlorfluormethan.php
© 1996 - 2025 Internetchemie ChemLin