Sulfurylchloridfluorid ist eine anorganisch-chemische Verbindung aus der Gruppe der Sulfurylhalogenide, dessen Molekül tetraedrisch mit einem zentralen Schwefel-Atom aufgebaut ist.
Bezeichnungen und Identifikatoren
Sulfurylchloridfluorid
ClFO2S
SO2ClF
118,506 (g/mol)
13637-84-8
237-126-2
IXPAAHZTOUOJJM-UHFFFAOYSA-N
Weitere Bezeichnungen, Synonyme
Sulfurylfluoridchlorid
Englische Bezeichnung
Sulfuryl chloride fluoride
Chloridofluoridodioxidosulfur; Chlorosulphonyl fluoride; Chloro fluoro sulfone
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Sulfurylchloridfluorid:
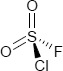
ClFO2S oder SO2ClF
Mr = 118,5064 g/mol
SMILES: O=S(=O)(F)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Sulfurylchloridfluorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Unter Standardbedingungen ist Sulfurylchloridfluorid ein farbloses, stechend riechendes, leicht kondensierbares Gas, das bei Kontakt mit Wasser hydrolysiert.
+ Löslich in Ether, flüssigem SO2.
- In Wasser erfolgt Zersetzung.
-124,7 °C
7,1 °C
1,623 g cm-3 bei 0 °C
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Sulfurylchloridfluorid - ClFO2S - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Chlor
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 22,67481 %
36Cl: Spuren
37Cl: 7,23919 %
Fluor
19F: 18,9984 u [100 %]
19F: 16,03154 %
Sauerstoff
ΣAr = 31,998 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 26,93546 %
17O: 0,01035 %
18O: 0,05535 %
Schwefel
32S: 31,97207 u [94,954 %]
33S: 32,97146 u [0,763 %]
34S: 33,96787 u [4,365 %]
35S: 34,96903 u [<< 1 %]
36S: 35,96708 u [0,016 %]
32S: 25,68828 %
33S: 0,20642 %
34S: 1,18088 %
35S: Spuren
36S: 0,00433 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 118,506403163 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 8,438 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,008 mol.
Monoisotopische Masse: 117,9291562645 Da - bezogen auf 35Cl19F16O232S.
Synthese, Gewinnung
Eine klassische Synthese-Methode zur Darstellung von Sulfurylchloridfluorid ist die durch Antimonpentachlorid katalysierte Reaktion zwischen Sulfurylchlorid und Antimontrifluorid in einem Druckgefäß - wie einem Autoklaven - bei einer Temperatur von 300 °C:
3 SO2Cl2 + SbF3 → 3 SO2ClF + SbCl3.
Eine andere Reaktion entweder von Ammoniumfluorid oder Kaliumfluorid mit Sulfurylchlorid in Gegenwart von Trifluoressigsäure ergibt bei Umgebungstemperatur Sulfurylchloridfluorid in guten bis mäßigen Ausbeuten, jedoch mit weniger apparativem Aufwand:
SO2Cl2 + NH4F → SO2ClF + NH4Cl.
Verwendung
Verflüssigtes Sulfurylchloridfluorid wird als Lösungsmittel, unter anderem für stark oxidierende Verbindungen wie beispielsweise Fluorantimonsäure, verwendet. Synthesechemikalie.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)


Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H301
Giftig bei Verschlucken. - H311
Giftig bei Hautkontakt. - H314
Verursacht schwere Verätzungen der Haut und schwere Augenschäden. - H318
Verursacht schwere Augenschäden. - H331
Giftig bei Einatmen.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.033.737 sowie Informationen zu REACh unter ECHA Chem 100.033.737.
Externe Informationsquellen
Hersteller und Bezugsquellen
Sulfurylchloridfluorid als kommerzielles Produkt von international tätigen Lieferanten und Suche nach Analoga siehe unter: ZINC000256056034.
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Sulfurylchloridfluorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - V. Prakash Reddy, Donald R. Bellew, G. K. Surya Prakash:
A convenient preparation of sulfuryl chloride fluoride.
In: Journal of Fluorine Chemistry, (1992), DOI 10.1016/S0022-1139(00)81102-1.
Letzte Änderung am 19.02.2024.
Permalink: https://www.internetchemie.info/substanz/Sulfurylchloridfluorid.php
© 1996 - 2026 Internetchemie ChemLin