2-Chlor-1,1,1-trifluorethan ist eine partiell halogenierte organisch-chemische Verbindung aus der Klasse der Fluorchlorkohlenwasserstoffe (FCKW), die häufig auch als HFCKW-133a bzw. - im englischen Sprachraum - als HCFC 133a bezeichnet wird. Das Molekül basiert auf dem C2-Körper des Ethans, bei dem 4 der H-Atome durch ein Chlor- und drei Fluor-Atome ersetzt sind.
Bezeichnungen und Identifikatoren
2-Chlor-1,1,1-trifluorethan
C2H2ClF3
118,483 (g/mol)
75-88-7
200-912-0
CYXIKYKBLDZZNW-UHFFFAOYSA-N
Systematischer Name
2-Chloro-1,1,1-trifluorethan
Weitere Bezeichnungen, Synonyme
1-Chlor-2,2,2-trifluorethan; Chlortrifluorethan
Englische Bezeichnung
2-Chloro-1,1,1-trifluoroethane
1,1,1-Trifluoroethyl chloride; (Chloromethyl)trifluoromethane; Chlorotrifluoroethane
Handelsnamen; Präparate
FC 133a; Fluorinol 85; Fluorocarbon 133a; R-133a; R 133a; HCFC-133a; HFCKW-133a; Freon 133a; Forane 133a; Genetron 133a; 2-CTE
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung 2-Chlor-1,1,1-trifluorethan:
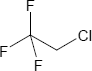
C2H2ClF3
Mr = 118,4832 g/mol
2-Chloro-1,1,1-trifluorethan
SMILES: C(C(F)(F)F)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: 2-Chlor-1,1,1-trifluorethan. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reiner Form und unter Standarbedingungen liegt 2-Chlor-1,1,1-trifluorethan als farbloses, geruchloses, wasserunlösliches, nicht brennbares Gas vor, dass unter dem eigenen Dampfdruck als Flüssigkeit kondensiert in Gasflaschen in den Handel gelangt.
- Unlöslich in Wasser (9,2 mg/L bei 25 °C).
- Verteilungskoeffizient logP = 1,67.
-105,5 °C
6,9 °C
1,389 g cm-3 bei 0 °C
1,559 bar bei 20 °C
nD = 1,3092 bei 0 °C
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung 2-Chlor-1,1,1-trifluorethan - C2H2ClF3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 24,022 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 20,05969 %
13C: 0,21491 %
14C: Spuren
Wasserstoff
ΣAr = 2,016 u
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 1,00783 u [99,99 %]
2H: 0,00017 %
3H: Spuren
1H: 1,70134 %
Chlor
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 22,67925 %
36Cl: Spuren
37Cl: 7,2406 %
Fluor
ΣAr = 56,995209489 u
19F: 18,9984 u [100 %]
19F: 48,10404 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 118,483209489 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 8,44 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,008 mol.
Monoisotopische Masse: 117,9797122534 Da - bezogen auf 12C21H235Cl19F3.
Synthese, Gewinnung
HCFC-133a wird durch Fluorierung von Trichlorethylen mit Fluorwasserstoff in Gegenwart eines Katalysators synthetisiert.
Verwendung
Frühere Anwendungen für 2-Chlor-1,1,1-trifluorethan: Treibmittel für Aerosol in Sprühdosen, Schäumungsmittel für Kunststoffe, Kühlmittel, Kältemittel. Noch praktische Anwendungen sind der Einsatz als Lösungsmittel und als Zwischenprodukt der chemischen Industrie, insbesondere für die Synthese von Halothan und Trifluoressigsäure.
Der Einsatz der synthetischen Verbindung HFCKW-133a sowie die dadurch verursachten Emissionen sind gemäß dem Montrealer Protokoll stark beschränkt bzw. verboten [1]. Dennoch gibt es Emissionen in die Atmosphäre - höchstwahrscheinlich als Zwischenprodukte chemischer Produktionsprozesse in Ostasien. Einen aktuellen Überblick hierüber bieten die unter [2] aufgeführten Forschungsergebnisse bzw. Messungen. Ozonabbaupotenzial: 0,060.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
H280Enthält Gas unter Druck; kann bei Erwärmung explodieren.
Kennzeichnung in der EU: Siehe ECHA Substance Infocard 100.000.830.
Externe Informationsquellen
Hersteller und Bezugsquellen
2-Chlor-1,1,1-trifluorethan als kommerzielles Produkt von international tätigen Lieferanten und Suche nach Analoga siehe unter: ZINC000040135787.
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von 2-Chlor-1,1,1-trifluorethan als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - Martin K. Vollmer, Matt Rigby, Johannes C. Laube et al.:
Abrupt reversal in emissions and atmospheric abundance of HCFC‐133a (CF3CH2Cl).
In: Geophysical Research Letters, (2015), DOI 10.1002/2015GL065846.
[2] - Martin K. Vollmer, Jens Mühle, Stephan Henne et al.:
Unexpected nascent atmospheric emissions of three ozone-depleting hydrochlorofluorocarbons.
In: Proceedings of the National Academy of Sciences, (2021), DOI 10.1073/pnas.2010914118.
Letzte Änderung am 11.02.2024.
Permalink: https://www.internetchemie.info/substanz/2-Chlor-1,1,1-trifluorethan.php
© 1996 - 2024 Internetchemie ChemLin