Bariumcarbonat ist eine anorganische Verbindung, die chemisch als das Barium-Salz der Kohlensäure charakterisiert und zu den Erdalkalimetallcarbonaten gezählt wird.
Bezeichnungen und Identifikatoren
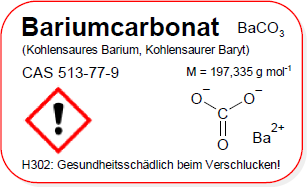
Bariumcarbonat
BaCO3
CBaO3
197,335 (g/mol)
513-77-9
208-167-3
AYJRCSIUFZENHW-UHFFFAOYSA-L
Weitere Bezeichnungen, Synonyme
Bariumkarbonat
Englische Bezeichnung
Barium carbonate
C.I. Pigment White 10
Farbstoff (oder Farbstoff-Vorstufe): Colour Index C. I. bzw. CI-Nummer
CI 77099; C.I. Pigment White 10
Handelsnamen; Präparate
Caswell No. 069
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Bariumcarbonat:
BaCO3 oder CBaO3
Mr = 197,335 g/mol
SMILES: C(=O)([O-])[O-].[Ba+2]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Bariumcarbonat. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand hat Bariumcarbonat das Aussehen einer weißen Substanz, die stabil, nicht-brennbar, geruchlos, geschmacklos und unlöslich in Wasser ist und mit den meisten Mineralsäuren die entsprechenden Bariumsalze bildet. Oberhalb von 1300 °C setzt thermische Zersetzung (Pyrolyse) zu Bariumoxid und Kohlendioxid ein, so dass das Carbonat keinen definierten Schmelzpunkt besitzt. Mohs-Härte: 3,5.
- Praktisch unlöslich in Wasser (20 mg/L bei 20 °C); Löslichkeitsprodukt Ksp = 2,58 × 10-9; die Löslichkeit steigt in Gegenwart von Ammonium-Ionen oder CO2. Unlöslich in Alkohol.
1380 °C
4,31 g cm-3 bei 20 °C
nD = 1,676
-1219 kJ/mol bei 25 °C
0,112 J/(mol K) bei 25 °C
-1139 kJ/mol
-58,9 × 10-6 cm3 mol-1
Orthorhombisch, Raumgruppe Pmcn, Raumgruppe Nr. 62 (5), a = 531,3 pm, b = 889,6 pm c =642,8 pm. Es existieren Hochtemperaturformen mit den Raumgruppen R3m (Nr. 166) und Fm3m (Nr. 225).
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Bariumcarbonat - BaCO3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Barium
130Ba: 129,90632 u [0,11 %]
132Ba: 131,90506 u [0,10 %]
134Ba: 133,90451 u [2,42 %]
135Ba: 134,90569 u [6,59 %]
136Ba: 135,90458 u [7,85 %]
137Ba: 136,90583 u [11,23 %]
138Ba: 137,90525 u [71,70 %]
130Ba: 0,07655 %
132Ba: 0,06959 %
134Ba: 1,6841 %
135Ba: 4,58603 %
136Ba: 5,46288 %
137Ba: 7,81505 %
138Ba: 49,8966 %
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 6,02209 %
13C: 0,06452 %
14C: Spuren
Sauerstoff
ΣAr = 47,997 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 24,26349 %
17O: 0,00933 %
18O: 0,04986 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 197,335 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 5,068 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,005 mol.
Monoisotopische Masse: 197,889990857 Da - bezogen auf 138Ba12C16O3.
Vorkommen
Die Substanz tritt in der Natur als Bariumcarbonat-Mineral Witherit auf, das der Aragonit-Gruppe zugeordnet wird, einer Klasse von wasserfreien Carbonaten ohne fremde Anionen. Witherit kristallisiert im orthorhombischen System und erscheint in verschiedenen Färbungen - je nach Begleistoffen bzw. Verunreinigungen: Farblos, milchig-weiß, grau, hellgelb oder grün bis hellbraun. Das spezifische Gewicht beträgt 4,3. Witherit fluoresziert sowohl unter lang- als auch kurzwelligem UV- Licht hellblau und unter kurzwelligem UV- Licht phosphoreszierend.
Synthese, Gewinnung
Bariumcarbonat wird industriell nach dem Soda-Verfahren hergestellt, bei dem eine Bariumsulfid-Lösung mit Natriumcarbonat versetzt wird, wobei das Carbonat und Natriumdisulfid entstehen. Die Reaktionstemperatur liegt zwischen 60 und 70 °C. Die resultierende Aufschlämmung wird filtriert und das Bariumcarbonat wird gewaschen, getrocknet, gemahlen und verpackt.
Bei enem anderen Verfahren wird Kohlendioxid durch eine Bariumsulfid-Lösung bei 40 bis 90 °C geleitet; als Nebenprodukt entsteht Schwefelwasserstoff:
BaS + H2O + CO2 → BaCO3 + H2S.
Verwendung
Bariumcarbonat ist Ausgangschemikalie für die Synthese anderer Barium-Verbindungen.
In industriellen Prozessen kann die Chemikalie zur Entfernung von Sulfat-Verunreinigungen eingesetzt werden.
In der Ziegel-, Fliesen-, Steingut- und Keramikindustrie wird den Tonen Bariumcarbonat zugesetzt, um lösliche Salze (Calciumsulfat und Magnesiumsulfat) auszufällen, die Ausblühungen verursachen.
Darüber hinaus wirkt das Carbonat als Flussmittel, Mattierungs- und Kristallisationsmittel und ergibt in Kombination mit bestimmten Farboxiden einzigartige Farben.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H302
Gesundheitsschädlich bei Verschlucken.
LD50 (Ratte, oral): 418 mg/kg; LD50 (Maus, oral): 200 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.007.426 sowie Informationen zu REACh unter ECHA Chem 100.007.426.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Bariumcarbonat sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 001690.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Bariumcarbonat als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Barium_carbonate.
[1] - K. O. Strømme:
On the Crystal Structures of the High-temperature Forms of Strontium and Barium Carbonate and Structurally Related Compounds.
In: Acta Chemica Scandinavica, (1975), DOI 10.3891/acta.chem.scand.29a-0105.
Letzte Änderung am 24.10.2024.
Permalink: https://www.internetchemie.info/substanz/Bariumcarbonat.php
© 1996 - 2026 Internetchemie ChemLin