Chloroform ist eine organisch-chemische Verbindung aus der Gruppe der Chlorkohlenwasserstoffe und ein Vertreter der vier Chlormethane. Das Molekül besteht aus einem zentralen C-Atom, dass jeweils mit drei Chlor-Atomen und mit einem Wasserstoff-Atom verbunden ist.
Bezeichnungen und Identifikatoren
Chloroform
CHCl3
119,369 (g/mol)
67-66-3
200-663-8
HEDRZPFGACZZDS-UHFFFAOYSA-N
Systematischer Name
1,1,1-Trichlormethan
Weitere Bezeichnungen, Synonyme
Chloretherid; Methenylchlorid; Methinchlorid; Trichlormethan
INCI-Bezeichnung
CHLOROFORM
Englische Bezeichnung
Chloroform
Trichlorocarbon; Formyl trichloride; Methane trichloride; Methenyl trichloride
1,1,1-Trichloromethan
Handelsnamen; Präparate
R-20; TCM; Freon 20; Refrigerant-20
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Chloroform:
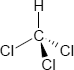
CHCl3
Mr = 119,369 g/mol
1,1,1-Trichlormethan
SMILES: C(Cl)(Cl)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Chloroform. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Chloroform ist in reinem Zustand eine farblose, flüchtige, sehr schlecht wasserlösliche, nicht brennbare Flüssigkeit, die bei etwa 61 °C siedet. Der Geruch der Chemikalie wird als charakterisitisch süßlich und charakterisitisch süßlich riechend beschrieben. Die Wahrnehmungsfähigkeit für den Geruch ermüdet sehr schnell. Die Geruchsschwelle liegt bei 205 - 307 ppm. Die Chemikalie zersetzt sich bei normaler Temperatur im Sonnenlicht in Abwesenheit von Luft sowie im Dunkeln in Gegenwart von Luft; als Stabilisator wird gegebenenfalls z. B. 2-Methyl-2-buten zugegeben (0,001 - 0,015 %) oder Ethanol zugesetzt. Beim Erhitzen zur Zersetzung können sich giftiges Phosgen-Gas sowie Chlor, Chlorwasserstoff, Kohlenmonoxid (CO) und andere bilden. Einige Arten von Kunststoffen, Gummi und Beschichtungen werden von Chloroform angegriffen. Die relative Verdunstungsrate (Butylacetat = 1) liegt bei 11,6.
+ Löslich in Aceton (> 100 g/L bei 19 °C), Dimethylsulfoxid, Benzol; mischbar mit Diethylether, fetten Ölen, Ligroin, Schwefelkohlenstoff, Tetrachlorkohlenstoff.
- Schlecht löslich in Wasser (8,7 g/L bei 23 °C).
- Verteilungskoeffizient logP = 1,97 bei 20 °C.
-63,47 °C
61,15 °C
1,4788 g cm-3 bei 25 °C
1,394 g cm-3 bei 60 °C
pK1s = 15,7 bei 20 °C
21,1 kPa bei 20 °C
32,1 kPa bei 30 °C
0,563 mPa s bei 20 °C
nD = 1,4459 bei 20 °C
-134,3 kJ/mol bei 25 °C
0,2029 kJ/(mol K) bei 25 °C
-71,1 kJ/mol
473,21 kJ/mol bei 25 °C
0,11425 kJ/(mol K)
1,04(2) D
11,42 EV
ε = 4,81 bei 20 °C
(Dielektrizitätskonstante)
-59,30 × 10-6 cm3 mol-1
Spektroskopische Daten:
In der NMR-Spektroskopie und für Forschungsanwendungen wird häufig deuteriertes Chloroform als protonenfreies Lösungsmittel eingesetzt - Siehe: Chloroform-d.
splash10-001r-9000000000-4c60f1e48cbdf424460b
splash10-001r-9000000000-d2165f9bfa5b3898f4d5
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Chloroform - CHCl3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 9,95542 %
13C: 0,10666 %
14C: Spuren
Wasserstoff
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 0,84436 %
2H: 8,0E-5 %
3H: Spuren
Chlor
ΣAr = 106,35 u
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 67,53286 %
36Cl: Spuren
37Cl: 21,56062 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 119,369 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 8,377 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,008 mol.
Monoisotopische Masse: 117,9143831022 Da - bezogen auf 12C1H35Cl3.
Vorkommen
Chloroform ist der am häufigsten vorkommende Halogenkohlenwasserstoff in der Atmosphäre - und hierbei ist die Chemikalie nicht nur anthropogenen Ursprungs, sondern stammt auch aus natürlichen Quellen. Viele Algen-Arten produzieren Chloroform, und es wird angenommen, dass auch Pilze Chloroform im Boden biosynthetisieren. Zudem können auch abiotische Prozesse im Boden zu den natürlichen Chloroform-Emissionen beitragen, obwohl der Mechanismus noch unklar ist.
Der globale Gesamtfluss von Chloroform durch die Umwelt wird auf etwa 660000 Tonnen pro Jahr geschätzt.
Wirkstoff Chloroform
ATC-Code:N01AB02
Chloroform ist ein starkes, allgemeines Anästhetikum (Betäubungsmittel), das zudem euphorisierend, angstlösend und beruhigend wirkt, wenn es eingeatmet oder eingenommen wird.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB11387 (Wirkstoff-Datenbank), NCI Thesaurus C29815 (Wirkstoff-Beschreibung).
Verwendung in Kosmetika
INCI-Bezeichnung: CHLOROFORM
In der EU verbotener Inhaltsstoff kosmetischer Mittel, auch in der Funktion als Lösungsmittel (Anhang II/366).
Zu den Einschränkungen und Beschränkungen bei der Verwendung von Chloroform in Kosmetika siehe Anhang II/366 der Verordnung (EG) Nr. 1223/2009 in der aktuellen Fassung.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 84482.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H302
Gesundheitsschädlich bei Verschlucken. - H315
Verursacht Hautreizungen. - H319
Verursacht schwere Augenreizung. - H331
Giftig bei Einatmen. - H351
Kann vermutlich Krebs erzeugen. - H361d
Kann vermutlich das Kind im Mutterleib schädigen. - H372
Schädigt die Organe bei längerer oder wiederholter Exposition.
Sicherheitshinweise: P201, P202, P260, P264, P270, P271, P280, P281, P301+330+331, P310, P302+352, P304+340, P311, P305+351+338, P308+313, P314, P332+313, P337+313, P362, P403+233, P235, P405, P501.
Chloroform wird als mäßig giftig eingestuft. Die wahrscheinliche orale letale Dosis für Menschen beträgt 0,5 bis 5 g / kg für eine 70 Kilogramm schwere Person. Die mittlere tödliche Dosis liegt wahrscheinlich etwa 44 g eingenommene Substanz, die zudem als menschliches Karzinogen gilt.
LD50 (Maus, dermal): 704 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.603 sowie Informationen zu REACh unter ECHA Chem 100.000.603.
Die WHO ordnet Chloroform in die IARC-Gruppe 2B ein: Möglicherweise krebserzeugend für den Menschen! Siehe dort unter Monografie Sup 7, 73, (1999).
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Chloroform sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 012870.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 56.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 0027 [englisch].
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1888.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Chloroform als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Chloroform.
[1] - Peter Watts:
Chloroform.
In: World Health Organization & International Programme on Chemical Safety, (2004), DOI https://apps.who.int/iris/handle/10665/42884.
[2] - M. Cappelletti, D. Frascari, D. Zannoni, S. Fedi:
Microbial Degradation of Chloroform.
In: Applied Microbiology and Biotechnology, (2012), DOI 10.1007/s00253-012-4494-1.
Letzte Änderung am 30.08.2024.
Permalink: https://www.internetchemie.info/substanz/Chloroform.php
© 1996 - 2026 Internetchemie ChemLin