L-DOPA ist eine organische Verbindung aus der Gruppe der α-Aminosäuren. Die Bezeichnung stellt eine Abkürzung für den chemischen Namen der Substanz L-3,4-Dihydroxyphenylalanin dar; häufig wird auch der Internationale Freiname (INN) Levodopa verwendet (L = Levo = Links, bezogen auf die stereochemische Orientierung des Moleküls).
Bezeichnungen und Identifikatoren
L-DOPA
C9H11NO4
197,19 (g/mol)
59-92-7
200-445-2
WTDRDQBEARUVNC-LURJTMIESA-N
Systematischer Name
3-Hydroxytyrosin
Weitere Bezeichnungen, Synonyme
(-)-DOPA; 3,4-Dihydroxy-L-phenylalanin
Englische Bezeichnung
L-DOPA
3,4-Dihydroxy-L-phenylalanine; 3-Hydroxy-L-tyrosine
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung L-DOPA:
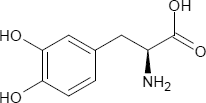
C9H11NO4
Mr = 197,19 g/mol
3-Hydroxytyrosin
SMILES: c1cc(c(cc1C[C@@H](C(=O)O)N)O)O
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: L-DOPA. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reiner Form ist L-DOPA ein geruchloses, geschmackloses, weißes, kristallines, stabiles Pulver; es kristallisiert aus Wasser in Form von Nadeln. Beim Erhitzen tritt oberhalb des Schmelzpunktes Zersetzung ein.
- Praktisch unlöslich in Alkohol. Wenig löslich in Wasser (3,3 g/L bei 25 °C).
- Verteilungskoeffizient logP = -2,39.
284 °C
225 °C
pK1s = 2,32
-13,1° (c=5,12 in 1n HCl bei 13 °C)
Raumgruppe P21 (Nr. 4), a = 1362,9(4) nm, b = 530,8(2) nm, c = 604,9(2) nm; Winkel α = γ = 90°, β = 97.53(1)° [vgl. A. Mostad, 1970].
Spektroskopische Daten:
splash10-014i-1890000000-646d209fa1943582a336
splash10-0udi-0900000000-b8a213a2bf5c3654c59b
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung L-DOPA - C9H11NO4 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 108,099 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 54,23863 %
13C: 0,58109 %
14C: Spuren
Wasserstoff
ΣAr = 11,088 u
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 1,00783 u [99,99 %]
2H: 0,00056 %
3H: Spuren
1H: 5,62244 %
Stickstoff
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 7,07634 %
15N: 0,02696 %
Sauerstoff
ΣAr = 63,996 u
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 15,99491 u [99,757 %]
17O: 0,01245 %
18O: 0,06653 %
16O: 32,37512 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 197,19 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 5,071 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,005 mol.
Monoisotopische Masse: 197,06880783445 Da - bezogen auf 12C91H1114N16O4.
Vorkommen
L-DOPA ist eine Vorstufe bei der Biosynthese von Botenstoffen im Organismus (Neurotransmitter Adrenalin, Noradrenalin, Betalaine und Dopamin) sowie von Melaninen und der Isochinolinalkaloiden. Die körpereigene Biosynthese erfolgt aus der Aminosäure L-Tyrosin unter dem Einfluss des Enzyms Tyrosinhydroxylase (TYH).
Synthese, Gewinnung
L-DOPA wurde nach dem 2. Weltkrieg von Roche industriell hergestellt, allerdings in zeitaufwendigen und komplizierten Synthese-Verfahren aus Vanillin und Hippursäure, damals schwer zu beschaffene Rohstoffe.
Nachdem Monsanto dann zum ersten Mal ein kommerzielles Verfahren für die L-DOPA-Synthese entwickelt hat, erfolgte der größte Teil der damaligen L-DOPA-Produktion nach der so genannten katalytisch asymmetrischen Methode, insbesondere nach der asymmetrischen Hydrierung, dem Monsanto-Prozess, den der Chemiker William Standish Knowles emtwickelt hat.
Die asymmetrische Synthese zeigte jedoch kritische Einschränkungen wie eine schlechte Umwandlungsrate und eine geringe Enantioselektivität. Dementsprechend wurden alternative biotechnologische Ansätze zur Überwindung der Mängel untersucht und entwickelt: Mikrobielle Fermentation unter Verwendung von Mikroorganismen mit Tyrosinase-, Tyrosinphenol-Lyase- oder p-Hydroxyphenylacetat-3-Hydroxylase-Aktivität und enzymatische Umwandlung durch immobilisierte Tyrosinase. Ajinomoto Co. Ltd vermarktete die Erwinia herbicola-Fermentation zur Herstellung von L-DOPA aus Catechol (Brenzcatechin). Darüber hinaus wurde das elektroenzymatische Umwandlungssystem als neue Methode eingeführt.
Heute wird L-DOPA überwiegend mit biotechnologischen Methoden hergestellt [vgl. K. Min et al., (2015)].
Wirkstoff L-DOPA
Internationaler Freiname (INN): Levodopa. Lateinische Bezeichnung: Levodopum.
ATC-Code:N04BA01
L-DOPA wird als Levodopa (Internationaler Freiname) einzeln oder in Kombination mit anderen Substanzen als Wirkstoff zur Behandlung der Parkinson-Krankheit und des Segawa-Syndrom (L-Dopa-sensitive oder responsive Dystonie, DRD, eine seltene Erbkrankheit) eingesetzt.
Im Gegensatz zum Neurotransmitter Dopamin vermag L-DOPA - eine biochemische Vorstufe des Dopamins) die Blut-Hirn-Schranke zu überwinden und die Dopamin-Konzentration im Gehirn zu erhöhen. Sobald L-DOPA in das Zentralnervensystem eingedrungen ist, wird es durch das Enzym Aromatische-L-Aminosäure-Decarboxylase (AADC), auch DOPA-Decarboxylase (DDC) genannt, in Dopamin umgewandelt. Das Vitamin B6 (Pyridoxalphosphat) ist hierfür ein erforderlicher Cofaktor und wird zusammen mit L-DOPA verabreicht.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB01235 (Wirkstoff-Datenbank).
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H302
Gesundheitsschädlich bei Verschlucken. - H315
Verursacht Hautreizungen. - H319
Verursacht schwere Augenreizung. - H335
Kann die Atemwege reizen. - H361
Kann vermutlich die Fruchtbarkeit beeinträchtigen oder das Kind im Mutterleib schädigen. - H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
LD50 (Ratte, oral): 1780 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.405 sowie Informationen zu REACh unter ECHA Chem 100.000.405.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von L-DOPA als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: L-DOPA.
[1] - A. Mostad, T. Ottersen,Chr. Romming:
X-Ray Crystal Structure Determination of 3,4-Dihydroxyphenylalanine (L-DOPA).
In: Acta Chemica Scandinavica, (1970), DOI 10.3891/acta.chem.scand.24-1864.
[2] - Kyoungseon Min, Kyungmoon Park, Don-Hee Park und Young Je Yoo:
Overview on the biotechnological production of L-DOPA.
In: Applied Microbiology and Biotechnology, (2015), DOI 10.1007/s00253-014-6215-4.
Letzte Änderung am 07.03.2024.
Permalink: https://www.internetchemie.info/substanz/L-DOPA.php
© 1996 - 2025 Internetchemie ChemLin